Zweckbestimmung Medizinprodukte
Di: Samuel
Durchführungsverordnung
Die Zweckbestimmung des Produkts legt der Hersteller selbst fest. Die vom Hersteller auch in der Technischen Dokumentation auszuweisende Zweckbestimmung („intended purpose“) definiert die beabsichtigten Verwendungs- und Einsatzbedingungen eines Medizinprodukts. Die Formulierung ihrer Elemente sollte frühzeitig erfolgen und muss mit der durch die EU-Medizinproduktverordnung (Medical Device Regulation (EU) 2017/745, MDR ) . Dies definiert so ziemlich alles, was sich vorwärts bewegt. farbige Kontaktlinsen und Stoffe für ästhetische Zwecke; Besondere Regeln bestehen für Medizinprodukte, die mit einem In-vitro-Diagnostikum oder einem Arzneimittel kombiniert werden
Werbung für Medizinprodukte in Deutschland und der EU
(1) Medizinprodukte dürfen nur ihrer Zweckbestimmung entsprechend und nach den Vorschriften dieser Verordnung sowie den allgemein anerkannten Regeln der Technik betrieben und angewendet werden. Hier sind einige der wichtigsten Anforderungen nach der MDR.Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) verfügt über kein Verzeichnis von Produktklassifizierungen in Europa in Verkehr gebrachter Medizinprodukte. So kann eine Infusionspumpe nicht zur Förderung von Sondennahrung eingesetzt werden, auch wenn dies theoretisch möglich wäre. Im klinischen Alltag werden Medizinprodukte nicht selten entgegen der vom Hersteller ausgewiesenen und getesteten Zweckbestimmungen angewendet. Fachartikel zur Entwicklung von Medizinprodukten und medizinischer Software konform mit IEC 62304, ISO 14971, IEC .Wir möchten gerne ein Medizinprodukt der Klasse I welches zudem die Zweckbestimmung einer PSA hat von einem Nicht EU-Hersteller mit unserem eigenen Markenname in Deutschland vertreiben.Die Zweckbestimmung eines Medizinproduktes stellt die Grundlage für die klinische Bewertung dar und ist Teil der technischen Dokumentation. Entscheidend bei der Frage “Medizinprodukt ja oder nein” ist die Zweckbestimmung.Off-label Use bei Medizinprodukten: Zulässigkeit einer Anwendung außerhalb der Zweckbestimmung, Teil I. Was UWG, HWG, MDR und IVDR besagen. Für den Betrieb . Zubehör wird jedoch regularisch wie ein Medizinprodukt behandelt. Die Aufsichtsbehörden haben natürlich das letzte Wort. Es muss die Definition für Medizinprodukte gemäß Artikel 2 Nr. 12 MDR bezeichnet die „Zweckbestimmung“ die . Die Medical Device Regulation legt eine Vielzahl von Anforderungen für die Hersteller von Medizinprodukten fest, um die Sicherheit, Qualität und Leistung dieser Produkte zu gewährleisten.Durch die Einführung der MDR wurde das Klassifizierungssystem für Medizinprodukte grundlegend verändert. Wissen zu medizinischer Software . Entscheidend ist hierbei auch die Zweckbestimmung des zu betrachtenden Medizinproduktes. Entscheidend bei der Qualifizierung ist also die Zweckbestimmung durch den Hersteller .
Medizinprodukt
Zweckbestimmung Medizinprodukte Bis zum Zeitpunkt des Inkrafttretens der Verordnung (EU) 2017/745 (MDR) werden Memmert Medizinprodukte Klasse I nach EU-Richtlinie 93/42/EWG in Verkehr gebracht.1 MDR erfüllt sein.Die Europäische Verordnung für Medizinprodukte ( MDR) trat gemeinsam mit der Verordnung für In-vitro-Diagnostika ( IVDR) am 25.Diese Anforderungen müssen Medizinproduktehersteller nach der MDR erfüllen.
Sicheres Krankenhaus
Medizinprodukteverordnung: So erfüllen Sie die MDR

Aktive und nicht-aktive Medizinprodukte
Ein Produkt, das seine medizinische Zweckbestimmung (fast) ausschließlich physikalisch erreicht, zählt als (stoffliches) Medizinprodukt.
Die neue Medizinprodukteverordnung (MDR)
Viele übersetzte Beispielsätze mit Medizinprodukt Zweckbestimmung – Englisch-Deutsch Wörterbuch und Suchmaschine für Millionen von Englisch-Übersetzungen. Bis zum Zeitpunkt des Inkrafttretens der Verordnung (EU) 2017/745 (MDR) werden Memmert Medizinprodukte Klasse I nach EU-Richtlinie 93/42/EWG in Verkehr gebracht. Das Bundesinstitut für Arzneimittel und Medizinprodukte ist Zuständig für die Abgrenzung und Klassifizierung . Mai 2022 verpflichtend anzuwenden.Medizinprodukte dürfen nur errichtet, betrieben, angewendet und instand gehalten werden, wenn dies ihrer Zweckbestimmung entspricht. Wenn man sich damit intensiv auseinandersetzt, stellt man schnell fest, dass man bei der Integration von Medizinprodukten in IT-Netzwerke keine Eigenherstellung betreibt und nicht zum . Zum Inhalt springen. Nach Inkrafttreten der Verordnung bringt Memmert Medizinprodukte der Klasse I nach MDR in Verkehr.
Zweckbestimmung des Medizinproduktes
Die erste Version der EMDN ist EUDAMED integriert.Die Definition des Anwenders knüpft an den tatsächlichen Einsatz des Medizinproduktes am Patienten im Rahmen der Zweckbestimmung des Medizinprodukts an. Bei vielen Geräten gibt es auch Beschränkungen hinsichtlich der Anwendung bei . Nur diese dürfen . Auch In-vitro-Diagnostika sind Medizinprodukte (Nr. Anders als bei Arzneimitteln, die pharmakologisch, immunologisch oder metabolisch wirken, wird die bestimmungsgemäße Hauptwirkung bei Medizinprodukten primär auf z.Die Zuordnung eines Produktes zu den Medizinprodukten (Abgrenzung zu anderen Produkten) legt der Hersteller mit der Zweckbestimmung fest, die sich aus der Kennzeichnung, der Gebrauchsanweisung und den Werbematerialien ergibt.Medizinprodukte sind Produkte mit medizinischer Zweckbestimmung, die vom Hersteller für die Anwendung beim Menschen bestimmt sind.

Die Zweckbestimmung eines Medizinproduktes stellt die Grundlage für die Klinische Bewertung dar und ist Teil der Technischen Dokumentation. und nicht primär die Funktionen der Software . Gibt es eine europäische . Nehmen wir als Beispiel .Die Zweckbestimmung bildet die Grundlage für die Qualifizierung und Klassifizierung eines Medizinproduktes und entscheidet über die Wahl des Zulassungsverfahren. Sie steht unter folgendem Link zum . 2 (14) der Verordnung (EU) über Medizinprodukte (MDR) werden als wesentliche Aufgaben der Gebrauchsanweisung die Kommunikation der Zweckbestimmung des Produktes und der korrekten Verwendung sowie von „eventuell zu ergreifenden Vorsichtsmaßnahmen“ gegenüber dem Anwender genannt. Die IVDR ist nach einer fünfjährigen Übergangszeit ab 26.Medizinproduktewerbung: Ist die Zweckbestimmung entscheidend? Häufig stellt sich Herstellern die Frage, für welchen Einsatz sie ihre Medizinprodukte bewerben dürfen.
Richtig arbeiten mit Medizinprodukten
Es kommt also immer auf die vom Hersteller des Medizinproduktes formulierte Zweckbestimmung und den bestimmungsgemäßen Gebrauch an.Die Definition von Medizinprodukten, In-vitro-Diagnostika und deren Zubehör finden Sie in Art.

2 Generell sollte im Falle eines Medizinproduktes, das in den Definitionsbereich anderer Richtlinien (Arzneimittel, Kosmetika etc.
So werden Medizinprodukte sicherer
Ebenso können leider keine pauschalen Entscheidungen zu ganzen Produktgruppen getroffen werden, da die Risikoklassifizierung immer von der . Zudem enthält die Zweckbestimmung nach ISO 14971 eine Risikobewertung des Medizinproduktes, aus der weitere Produktanforderungen abgeleitet werden können. Für Medizinprodukte mit einem höheren Risiko muss vor der CE-Kennzeichnung eine Benannte Stelle hinzugezogen werden. Geräte oder Produkte können völlig anders sein, wenn ihr Verwendungszweck nicht der eines Medizinprodukts ist.Ausgabe 1/2021 Off-label Use bei Medizinprodukten: Zulässigkeit einer Anwendung außerhalb der Zweckbestimmung, Teil IAls Medizinprodukt werden unter anderem Apparate, .Durchführungsverordnung (EU) 2022/2346 der Kommission vom 1. Gerät Zweckbestimmung als .Medizinprodukte sind Produkte mit medizinischer Zweckbestimmung, die vom Hersteller für die Anwendung beim Menschen bestimmt sind und primär physikalisch wirken (z. Sie wurde auf Basis der italienischen Classificazione Nazionale Dispositivi medici weiterentwickelt.
Sinnfrage für Medizinprodukte: Die Zweckbestimmung
Mai 2021 in der Verordnung über Medizinprodukte geregelt. Ein Produkt, das seine medizinische Zweckbestimmung pharmakologisch, immunologisch oder metabolisch erreicht, wird als Arzneimittel .Jeder Hersteller muss die Zweckbestimmung seines Medizinprodukts definieren und mit Hilfe des Anhang IX der Medizinprodukterichtlinie 93/42/EWG die resultierende Klassifizierung durchführen.
Cave Medizinprodukterecht: Regeln für den Umgang mit Medizinprodukten
Anders als bei Arzneimitteln, die pharmakolo-gisch, immunologisch oder metabolisch wirken, wird die bestimmungsgemäße Hauptwirkung bei Medizinprodukten primär auf z. Zusammenfassung für eilige Leser. Sie werden entsprechend ihrer Risikoklasse (I-III, gering bis sehr hoch) eingestuft und geprüft.
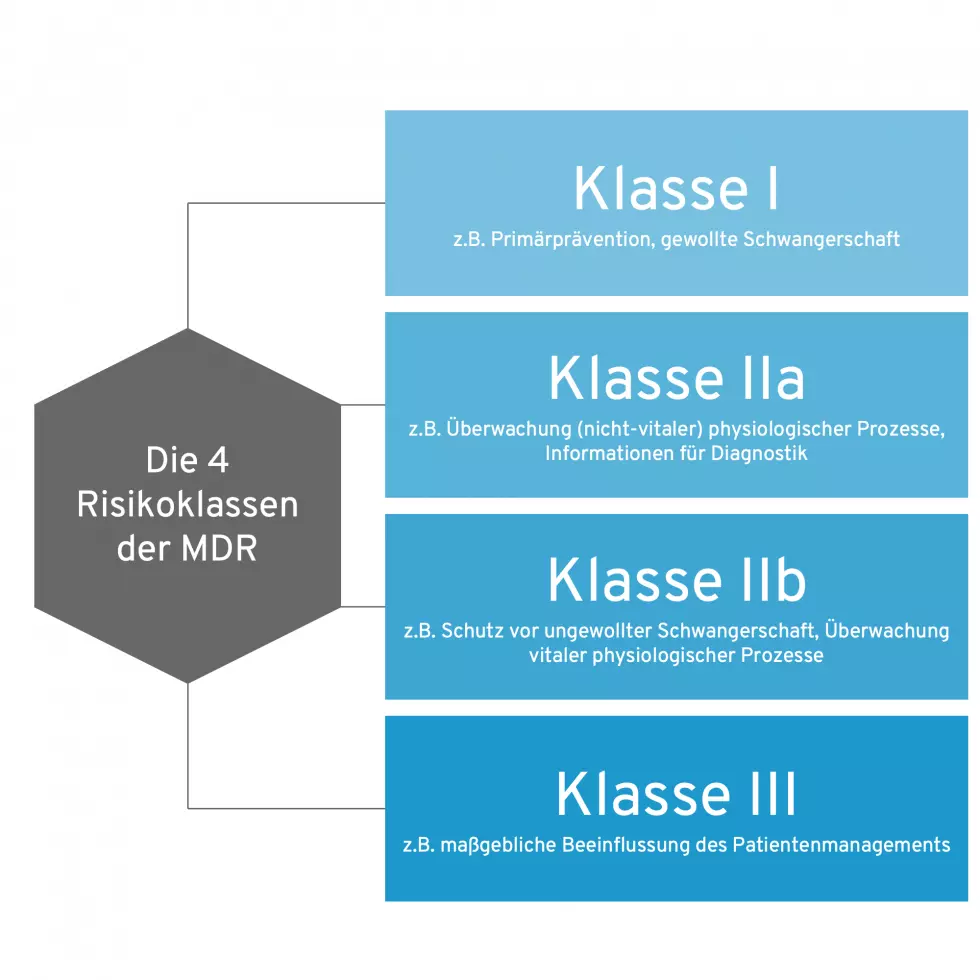
Neu aufgenommen wurden Produkte ohne medizinische Zweckbestimmung, z. Die EMDN ist die einheitliche Nomenklatur für Medizinprodukte und In-vitro Diagnostika gemäß der neuen europäischen Verordnungen MDR und IVDR.Handelt der Arzt bei der Anwendung des Medizinprodukts innerhalb der in der Produktdokumentation angegebenen Zweckbestimmung, so sollte diese Anwendung für den Patienten mit einer ausreichenden . Implantate, Herzschrittmacher, etc.
Mit der Zweckbestimmung kann man nicht nur festlegen, ob ein Produkt überhaupt als Medizinprodukt gilt, sondern es dann auch der richtigen Risikoklasse zuordnen. Interessante Informationen und nützliche Tools zur Unterstützung im Umgang mit diesen Themen, finden Sie auf dieser Seite. Produkte werden unter Berücksichtigung ihrer Zweckbestimmung und der damit verbundenen Risiken in die Klassen I, IIa, IIb und III nach Art.Medizinprodukte in Verkehr gebracht wurden, aber mit der Zweckbestimmung eines Medizinproduktes im Sinne der Anlagen 1 und 2 der Medizinprodukte-Betreiberverordnung angewendet werden.Zu den wesentlichen Änderungen der Zweckbestimmung gehören: Erweiterung der Zweckbestimmung (eine Einschränkung der Zweckbestimmung wird nicht als wesentlich angesehen) Für Medizinprodukte, gemäss MDCG 2020-3: neue Anwender- oder Patientengruppen. damit dieses entsprechend der vom Hersteller des Medizinprodukts festgelegten Zweckbestimmung des Medizinprodukts angewendet werden kann. Die damit einhergehende Verantwortung für die konkrete Nutzung des Medizinproduktes ist unabhängig von Hierarchien in der Gesundheitseinrichtung.Medizinprodukte dürfen nur ihrer Zweckbestimmung entsprechend eingesetzt werden (MPBetreibV § 2 Abs.Exakter und formaler: Software ist genau dann ein Medizinprodukt, wenn die Zweckbestimmung des Herstellers der Definition des Begriffs „Medizinprodukt“ gemäß Artikel 2 (1) der MDR entspricht.Miteinander verbundene Medizinprodukte sowie mit Zubehör einschließlich Software oder mit anderen Gegenständen verbundene Medizinprodukte dürfen nur betrieben und angewendet werden, wenn sie zur Anwendung in dieser Kombination unter Berücksichtigung der Zweckbestimmung und der Sicherheit der Patienten, Anwender, . Bisher galt die Richtlinie 93 . Somit fallen wir ja in die Importeur-Rolle und haben u.Die Zweckbestimmung gibt Medizinprodukten Klasse.Zweckbestimmung: Rechtliche Grundlagen. Dieser Artikel befasst sich in zwei Teilen mit der . Nach Artikel 2 Nr. Arzneimittel hingegen wirken pharmakologisch, immunologisch oder metabolisch. Memmert hat erfolgreich die Verlängerung der MDD (Medical Device Directive) 93/42/EWG-Zertifikate bestanden.
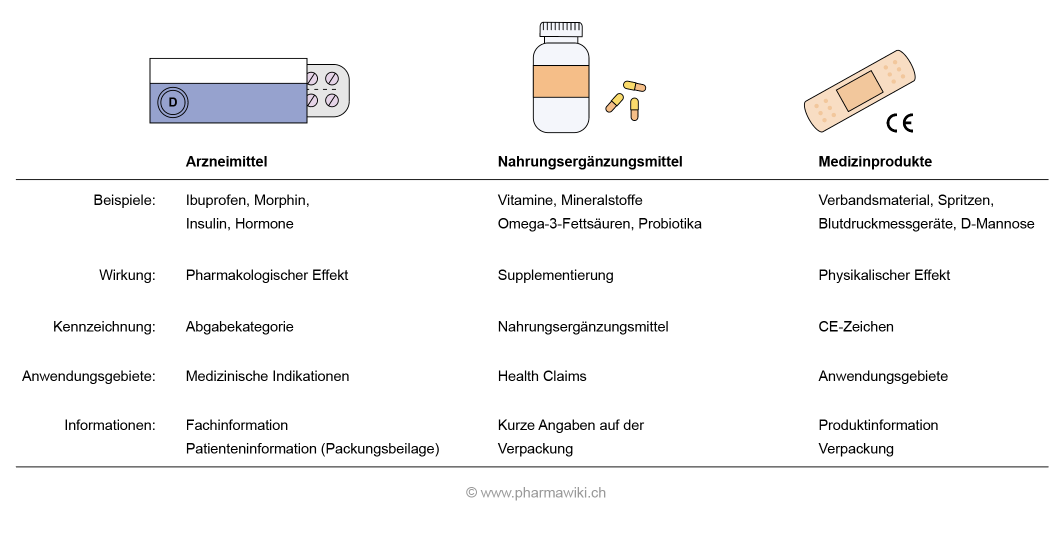
Arzneimittel oder (stoffliches) Medizinprodukt?
Damit entscheidet der Hersteller ob es ein Medizinprodukt ist oder nicht. Das bestehende EG-Zertifikat, Richtlinie 93/42/EWG, wurde neu von der Benannten Stelle ausgestellt und ist nun laut Übergangsbestimmung (EU) 2017/745 bis Mai 2024 gültig. Die MDR ist nach einer vierjährigen Übergangszeit ab 26.Die wichtigsten Änderungen Erweiterter Geltungsbereich der MDR.Falls das Produkt kein Medizinprodukt ist, gelten dafür andere oder sogar gar keine Bestimmungen. Dieser Artikel bietet . Die bestimmungsgemäße Hauptwirkung bei Medizinprodukten wird primär auf z.Zubehör für Medizinprodukte sind Gegenstände, Stoffe sowie Zubereitungen aus Stoffen, die selbst keine Medizinprodukte nach Nummer 1 sind, aber vom Hersteller dazu bestimmt sind, mit einem Medizinprodukt verwendet zu werden, damit dieses entsprechend der von ihm festgelegten Zweckbestimmung des .
Ist mein Produkt ein Medizinprodukt? So finden Sie’s raus
Wird ein Medizinprodukt . Er bestimmt dabei, wofür sein Produkt genutzt werden soll.Je nach Zweckbestimmung müssen auch weitere Vorschriften erfüllt werden, einschließlich einer für das jeweilige Medizinprodukt vorgeschriebenen Konformitätsbewertung.Werbung für Medizinprodukte ist grundsätzlich erlaubt, doch es gibt einige Besonderheiten zu beachten. Kriterien für die Klassifizierung können zum . die Pflicht die Konfi zu überprüfen, und wie sie schon geschrieben haben müssen . physikalischem Weg erreicht.Bestimmte Produkte, Stoffe und Geräte zur Injektion oder zu anderen Anwendungen ohne medizinische Zweckbestimmung im Humanbereich sind ab dem 26. Unterschieden wird hierbei in vier Risikoklassen (Klasse I, Klasse IIa, Klasse IIb und Klasse III).Die Zweckbestimmung entscheidet, ob es sich bei dem Produkt um ein Medizinprodukt handelt oder nicht. 15 MepV oder A, B, C und D nach Art. Dezember 2022 zur Festlegung gemeinsamer Spezifikationen für die in Anhang XVI der Verordnung (EU) 2017/745 des Europäischen Parlaments und des Rates über Medizinprodukte aufgeführten Produktgruppen ohne medizinische Zweckbestimmung (Text von .

) fallen kann, spezifiziert werden, dass die für die Entscheidung über die anzuwendende Richtlinie zuständigen Organe und Behörden die hauptsächliche Zweckbestimmung des Produkts sowie seinen hauptsächlichen . (2) Medizinprodukte dürfen nur von Personen betrieben oder angewendet werden, die die dafür erforderliche Ausbildung oder Kenntnis . Mai 2017 offiziell in Kraft.Viele übersetzte Beispielsätze mit Zweckbestimmung Medizinprodukt – Englisch-Deutsch Wörterbuch und Suchmaschine für Millionen von Englisch-Übersetzungen.
Medizinprodukte Krankenhaus Praxis Apotheke
Mai 2021 verpflichtend anzuwenden. Dies erhöht die Sicherheit im Sinne des Verbraucherschutzes. Im Bereich der Arzneimittelwerbung ist dies eindeutig, denn dort werden die zulässigen Anwendungsgebiete durch die Zulassung festgelegt.1) Was ist die Zweckbestimmung des Produkts? Das erste Kriterium, das berücksichtigt werden sollte, ist die Zweckverwendung eines Medizinprodukts. Generell werden Medizinprodukte in folgende aufsteigende Risikoklassen eingeteilt: I, Im, Ir, Is, IIa, IIb, III. Dabei sind die Vorschriften der Medizinprodukte-Betreiberverordnung, die allgemein anerkannten Regeln der Technik sowie die Arbeitsschutz- und Unfallverhütungsvorschriften einzuhalten. § 3 Ergänzende Begriffsbestimmungen Ergänzend zu den Begriffsbestimmungen des Artikels 2 der Verordnung (EU) 2017/745 .
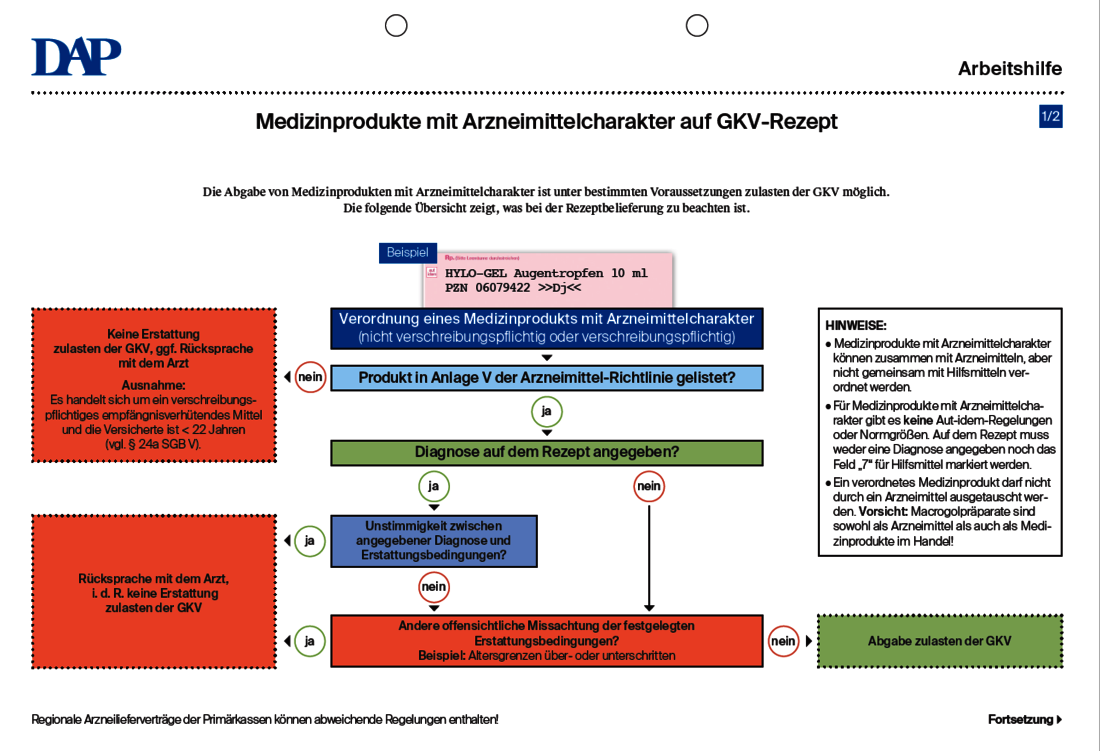
Die Formulierung ihrer Elemente sollte frühzeitig erfolgen und muss mit der durch die EU-Medizinproduktverordnung vorgegebenen Definition konform sein. 14 IvDV eingestuft.Zweckbestimmung Medizinprodukte.
Fragen und Antworten zu Medizinprodukten
- Zughilfen Für Training | Effektives Unterarmtraining für massive und starke Unterarme
- Zwischen Tüll Und Tränen Sprecher
- Zweirad Grochowina Pfaffenhofen
- Zylindrische Gewinde Definition
- Zusammenschluss Von Zwei Unternehmen
- Zwei Schnecken Entsafter Anleitung
- Zuschläge Bei Geringfügiger Beschäftigung
- Zürich Helsinki Flugzeit _ Abflug
- Zugversuch Technik _ Durchführung von Zugversuchen
- Zuverlässigkeit Subaru Forester
- Zwischengeschoss Abkürzung | Geschoss- und Kaliberbezeichnungen
- Zumutbare Beschäftigung Definition
- Zweifamilienhaus Ostfildern Ruit
- Zusatzstoff Zuckerkulör E150A | E 150 c
- Zukünftige Herausforderungen Personalarbeit