Warum Ist Sauerstoff Ein Diradikal
Di: Samuel
Sauerstoff wird von Lebewesen benötigt, um Zellen im Körper zu erhalten oder zu produzieren. Die Toxikose kann verschiedene Körpersysteme beeinträchtigen, .Lewis Schreibweise Beispiele. Stickstoffmonoxid • ½ N 2 + 1/2 O 2 ↔NO ∆H B°= +90kJ/mol • Farbloses, giftiges Gas • Bis etwa 400°C metastabil • Zwischenprodukt bei der Salpetersäureherstellung • Herstellung: Ostwald .
Warum brauchen Lebewesen Sauerstoff
Sauerstoff stellt ein einzigartiges Element dar, da er zum einen im Grundzustand als Diradikal (Triplettzustand), zum anderen auch im angeregten Singulettzustand vorliegen kann. Der energiereichere Singulett-Sauerstoff hat eine Lebensdauer von ca. Ein Radikal, häufig eine reaktive Sauerstoffspezies (ROS), greift die Fettsäure an. Lebewesen atmen dann den Sauerstoff ein und Kohlendioxid wieder aus. (02:25) Kohlenstoffdioxid (CO2) Lewis Formel. Als Bestandteil der Oxide und anderer Verbindungen (z. Wie bereits erwähnt, hat Sauerstoff sehr starke Anziehungskräfte und kommt in sehr vielen Bindungen vor.2024 Elektrodynamik.
Vitamin C
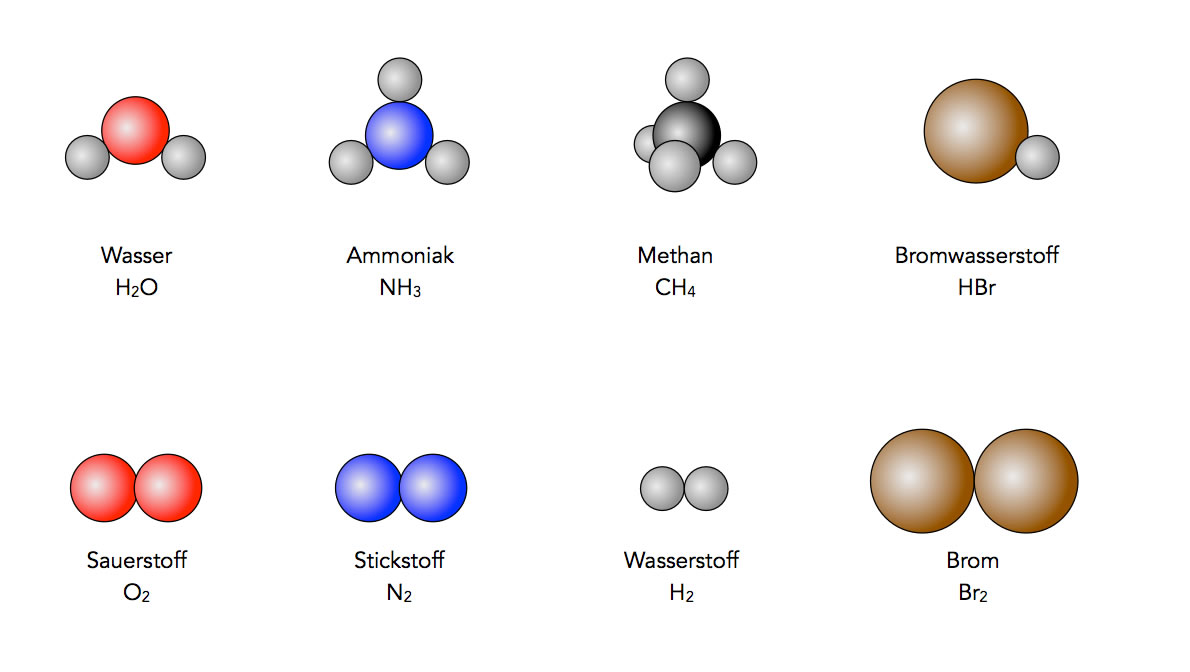
Zu diesem Thema gibt es aber noch .
Aufgrund seiner Valenzelektronenkonfiguration von 2s22p4 ist Sauerstoff zweibindig: Im O 2 -Molekül liegt eine Doppelbindung vor. Hier fehlt nicht ein Elektron in der Valenzschale, sondern es kommen zu viele vor. Radikale werden mit einem ‚Punkt‘ dargestellt, zum Beispiel Stickstoffmonoxid (NO • ), der das freie Elektron symbolisiert.
Warum ist o2 ein diradikal?
Denn das O₂-Molekül kannst du mit einer Lewisformel nicht mehr darstellen, auch nicht mit geeigneten Hybridisierungen. Sauerstoff ist für Menschen, Tiere und Pflanzen überlebenswichtig. Der Grund hierfür ist die Assoziation der Moleküle über Wasserstoff-Brückenbindungen.
Warum ist das Sauerstoffmolekul O2 ein unpolares Molekul?
Das O 2 -Molekül ist also ein Diradikal mit einem Triplett . Inhaltsübersicht. Sauerstoff ist zweiatomig, weil er am stabilsten ist, wenn er an ein anderes Sauerstoffatom gebunden ist, sodass die beiden Atome ihre äußere Hülle vervollständigen und ein stabiles .Zu den Sauerstoffverbindungen gehören die aliphatischen Alkohole, die aromatischen Phenole und die Ether. Den genauen Mechanismus, Ablauf, die Besonderheiten dieser Reaktion und ein paar Beispiele lernst du in diesem Beitrag kennen. Forschungsteam beobachtet direkt den .Er sieht aus wie Vogeldreck und wäre daher fast übersehen worden: Ein neu entdeckter Sechsbeiner kommt ziemlich flauschig daher und bildet gleich eine neue Gattung.
Sauerstoff
Die Molekülorbitaltheorie (kurz MO-Theorie) ist neben der Valenzbindungstheorie (VB-Theorie) eine von zwei komplementären Möglichkeiten, die Elektronen struktur von Molekülen zu beschreiben. Nun, das war nur eine einfache Antwort.Die radikalische Substitution (kurz S R) ist ein Reaktionstyp der organischen Chemie, bei dem an einem sp 3 – substituierten Kohlenstoffatom ein Wasserstoffatom ersetzt wird, häufig durch Halogen – oder Sauerstoff -Atome (z. Er kann relativ einfach gelagert und transportiert werden.Molekülorbitaltheorie.
Anorganische Peroxide und Radikale
Sauerstoffradikale. Das Molekül wird mit O 2 3 bezeichnet.Video ansehenElektronenstruktur und Lewis-Formel des Sauerstoffs – Chemie.Sauerstoff ist ein Element der VI.Daher ist das nicht so gefährlich, wie wenn Taucher sich über eine Druckluftflasche mit Sauerstoff versorgen – und das womöglich noch einige Dutzend Meter unter der Wasseroberfläche, wo der .
![Kernfusion • Definition, Beispiele und Anwendung · [mit Video]](https://d3f6gjnauy613m.cloudfront.net/system/production/videos/002/002/703ab55c817cdb250d84b654c36cf0c1959fb17f/Kernfusion_Thumbnail.png?1651856694)
Lipidperoxidation
Bei 3000 o C sind damit z.Reaktive Sauerstoffspezies. Beim MO-Verfahren werden über das Molekül delokalisierte Molekülorbitale durch eine Linearkombination der Atomorbitale .
Radikalische Substitution
Radikale werden mit einem ‚Punkt‘ dargestellt, zum Beispiel Stickstoffmonoxid (NO •), der das freie Elektron symbolisiert.
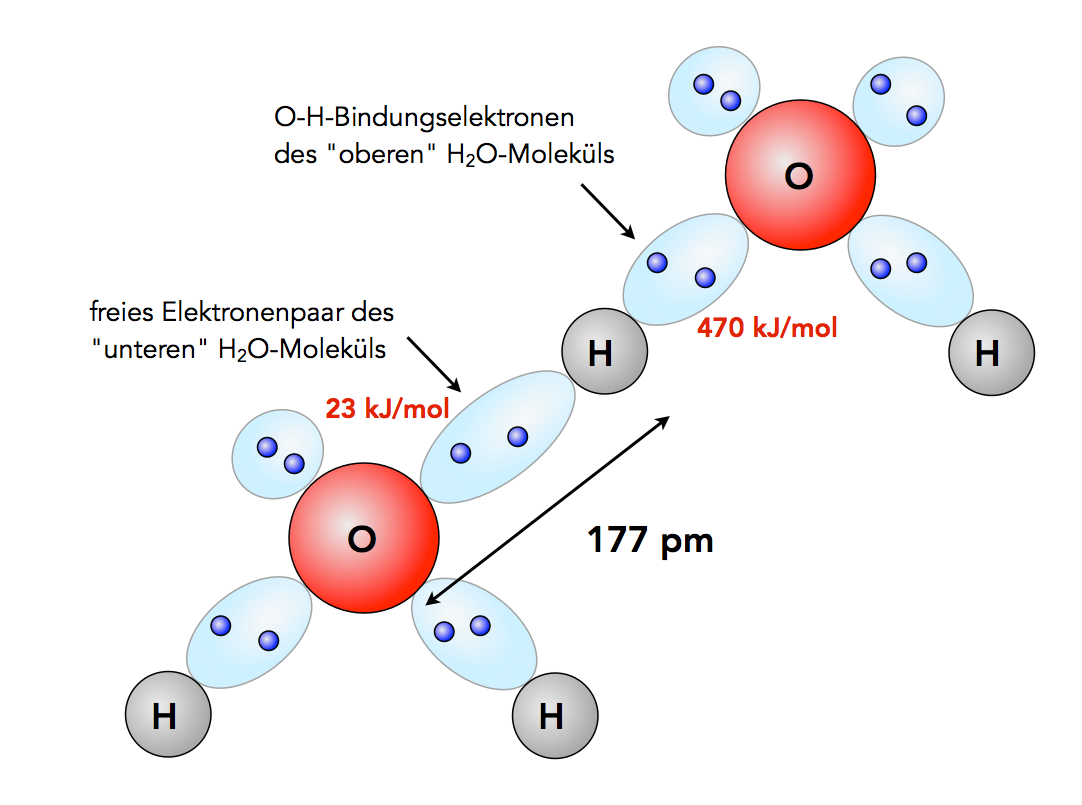
Der Grund hierfür ist die Assoziation der Moleküle über Wasserstoff-Brückenbindungen, wobei ein H-Atom mit dem freien .Juli 23, 2023 von Chemuza-Team.Sie tritt auf, wenn über einen längeren Zeitraum Sauerstoffkonzentrationen verabreicht werden, die über dem normalen atmosphärischen Partialdruck liegen.Warum ist das Sauerstoffmolekül O2 ein unpolares Molekül? Das Sauerstoff-Atom besitzt im Grundzustand sechs Valenzelektronen. Enthält ein Radikal mehrere ungepaarte Elektronen, spricht man von Diradikal (auch .
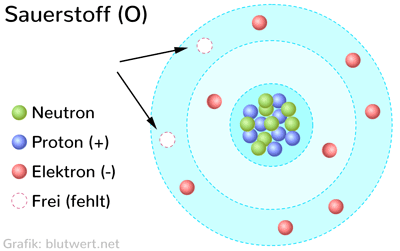
Elektronen-Struktur des Sauerstoffs
An Vorkenntnissen solltet ihr die organische Chemie bis Alkene und Alkohole beherrschen. Es ist ein farb- und geruchloses Gas, das in der Luft zu 21 % enthalten ist.Sauerstoff, ein „Diradikal“, gehört zu den wenigen Molekülen, die stabil sind, ohne dass sich im Grundzustand für die Summe der (magnetischen) Spinquantenzahlen 0 ergibt, ohne also dass alle Elektronen spingepaart vorliegen.
Was sind sauerstoffradikale?
reactive oxygen species, ROS) – auch oft ungenau als Sauerstoffradikale bezeichnet – sind schädliche Formen des Sauerstoffs, die bei oxidativem Stress und damit bei verschiedensten Erkrankungen sowie beim Alterungsprozess eine wesentliche pathophysiologische Rolle spielen. In der Pathophysiologie spielen diese Sauerstoffformen insbesondere beim sog. So leid mir’s tut, schuld ist der, der dir so ein falsches Bild vor die Nase gehalten hat. Normler Sauerstoff ist ein Radikal, genauer ein Diradikal, enthält also 2 ungepaarte Elektronen. Als Radikale bezeichnet man reaktionsfreudige Atome oder Moleküle. Dabei werden aus Kohlenwasserstoffen zunächst Hydroperoxide gebildet, die langsam zu Alkoholen, Aldehyden, Ketonen und . Die Autoxidation verläuft sehr langsam und ohne merkliche Wärmeentwicklung oder Flammenerscheinung, im Gegensatz zur Verbrennung.Warum ist o2 ein diradikal? Diradikale sind Atome, Moleküle oder Ionen, die mit zwei ungepaarten Elektronen eine besondere Elektronenstruktur aufweisen. Das Diradikal Sauerstoff wird dringend benötigt für die Atmung.Der O-O-Abstand d O-O beträgt 121 pm, die Dissoziationsenergie ist 498 kJ/mol. 6% der Moleküle bereits dissoziiert. Radikale spielen eine wichtige Rolle bei bestimmten Oxidationsprozessen, bei Polymerisationen und bei . Zwei Elektronen in zwei p-Orbitalen, sagen wir, den p_x Orbitalen wuerden dann eine weitere Zweielektronenbindung bilden.
Reaktionen unter Beteiligung von Sauerstoff wie die Verbrennung von Kohle oder von Kohlenhydraten .Großtechnisch von Bedeutung ist die Chlorierung von Kohlenwasserstoffen (s. Kinder Vom ersten Schrei über die ersten Worte, Schritte, Trotzanfälle bis zum Abnabeln von den Eltern in der Pubertät: Die Kindheit ist eine ganz besondere Phase, die fürs Leben prägt. Dadurch entsteht das reaktive Fettsäure-Radikal. Da die Bindung hier von zwei Elektronenpaaren bewirkt wird, spricht man auch von einer Doppelbindung.Warum ist o2 ein diradikal? Sauerstoff, ein „ Diradikal “, gehört zu den wenigen Molekülen, die stabil sind, ohne dass sich im Grundzustand für die Summe der Spinquantenzahlen 0 ergibt, ohne also dass alle Elektronen spingepaart vorliegen.Enthält ein Radikal mehrere ungepaarte Elektronen, spricht man von .
Radikale (Chemie)

Warum ist O2 ein diradikal? Das Sauerstoff-Atom besitzt im Grundzustand sechs Valenzelektronen. (03:32) Die Lewis Forme l ist eine Methode, um Moleküle darzustellen.
Sauerstoff und Sauerstoffverbindungen in Chemie
Ohne ihn wäre das Leben auf der Erde, wie wir es kennen, nicht möglich. Das ist nur mit dem Molekülorbitalmodell (Mo-Modell) erklärbar. Das MO-Schema von Sauerstoff (Abb. Metalle können durch . MO-Schema von elementarem Sauerstoff ‣ SVG. Oft dienen Spuren von Metallionen als Initiatoren für diese Kettenreaktion. Der Film gehört zur Reihe Reaktionsmechanismen.
Autoxidation
Autoxidation bezeichnet eine Oxidation durch Luft sauerstoff. Auch Sauerstoff an sich ist ein Diradikal, das mit der Zwischenstufe Ascorbin-Ion . In hohen Dosierungen kann Vitamin C eine pro-oxidative Wirkung haben.Sauerstoff als Diradikal greift hierbei die besonders aktivierte benzylische Position des Cumols an: dabei bildet sich ein tertiäres benzylisches Radikal I, welches sich mit dem Luftsauerstoff zum Peroxyradikal II umsetzt. Das ist denn auch das Hauptproblem . In diesem Text werden wir die Elektronenstruktur des . Sauerstoff ist ein Nichtmetall , da ihm metallische Eigenschaften wie Glanz, Formbarkeit und Duktilität fehlen. Der Sauerstoff der Luft ist im Grundzustand ein Triplett-Zustand mit parallelen Elektronenspins der ungepaarten Elektronen.Einer davon ist die sogenannte radikalische Substitution.) Wichtig ist auch die Reaktion von organischen Substanzen mit dem Diradikal Sauerstoff unter relativ milden Bedingungen, die Autoxidation. Falls dir das audio-visuelle Lernen eher zusagt, dann haben wir für dich ebenfalls ein Video erstellt. Die Reaktion verläuft als Radikalkettenreaktion über drei Reaktionsschritte: Startreaktion . Sauerstoff • Permanentes Diradikal • Bindungsordnung 2 • Oxidationsmittel • Metastabil ÆUnter Normalbedingungen reaktionsträge.Warum ist o2 ein diradikal? Sauerstoff, ein „Diradikal“, gehört zu den wenigen Molekülen, die stabil sind, ohne dass sich im Grundzustand für die Summe der Spinquantenzahlen 0 ergibt, ohne also dass alle Elektronen spingepaart vorliegen.• Diradikal: • Triradikal . Sauerstoff ( \ce {O2} OX 2) ist ein sehr wichtiges Element.Wer hier schon länger im Blog ließt, der ist sicher schon über die Radikalen und Oxidantien wie Superoxid (H 2 O 2) und Peroxinitrid (ONOO‾) gestolpert – speziell im Zusammenhang mit elektromagnetischen Feldern (), chronischen Entzündungen, Nitrostress, EHS, MCS, CFS, und vielen mehr.Sauerstoff ist ein zweiatomiges STP-Molekül , das aus zwei Sauerstoffatomen besteht, die durch eine kovalente Bindung verbunden sind.Dabei entstehen kurzkettige Alkane, Alkene und Wasserstoff durch Dehydrierung. In den p_y Orbitalen waeren dann aber 4 Elektronen, die . Als reaktive Sauerstoffspezies, kurz ROS, sind Sauerstoff -enthaltende Moleküle mit sehr großer chemischer Reaktionsbereitschaft.Warum ist Sauerstoff ein diradikal? Diradikale sind Atome, Moleküle oder Ionen, die mit zwei ungepaarten Elektronen eine besondere Elektronenstruktur aufweisen.) zeigt jedoch, dass es sich um ein Diradikal handelt: Abb.3 Starke Elektronenräuber. ROS entstehen durch die Aufnahme zusätzlicher Elektronen durch den Sauerstoff. bei der Autoxidation ). Dabei wird der elementare Sauerstoff über die roten Blutkörperchen zu den einzelnen Zellen transportiert. Diese besitzen mindestens ein ungepaartes Elektron. Dabei kann es vorkommen, dass .Wenn nicht, dann bist du hier genau richtig! In diesem Artikel erklären wir dir, was medizinischer Sauerstoff ist und wie er bei medizinischen Anwendungen verwendet wird. Sauerstoff, im Grundzustand ein Diradikal, bindet im Zuge einer radikalischen Substitution an das Fettsäure-Radikal, wodurch ein Lipidperoxyl-Radikal entsteht.Sauerstoff (auch Oxygenium; von griech. Es ist außerdem ein stark elektronegatives Element, das dazu neigt, Elektronen aufzunehmen und so negative Ionen zu bilden. Das O 2 -Molekül ist also ein Diradikal mit einem Triplett-Grundzustand (Paralleler Spin; O 2 ( ∑ 3 g + )). Es ist für alle Verbrennungs – und Korrosionsvorgänge nötig.
Radikale (Chemie)
Für die Sauerstoffproduktion wandeln Pflanzen Kohlendioxid in Sauerstoff um. Dieses kann von weiterem Cumol ein H-Atom abstrahieren unter Bildung des Cumolhydroperoxids und Radikal I (radikalische . Wie du sie aufstellst und was sie von anderen Strukturformeln unterscheidet, zeigen wir dir hier und im Video.Als Sauerstofftoxikose bezeichnet man die schädigende Wirkung von Sauerstoff (O 2) auf den Körper. Alkohole (Alkanole) enthalten eine oder mehrere OH-Gruppen im Molekül.
Freie Radikale und Oxidantien: O2-, H2O2, OH, NO und ONOO
10–4 s, und seine Elektronen sind gepaart, d. Sauerstoff ist das häufigste Element auf der Erde.Wasserstoff gilt als der Idealstoff der Energiewende: Er lässt sich leicht herstellen und kommt in nahezu unendlichen Mengen vor. Wenn man Wasserstoff schließlich in einer Brennstoffzelle zu Strom umwandelt, werden keine Abgase ausgestoßen.Theorie voraussetzt, warum Sauerstoff ein Diradikal ist, ist folgende: Haette Sauerstoff eine echte Doppelbindung, waere eine davon eine Sigma Bindung. Mein Ziel ist es, euch mit Umlagerungen am Beispiel kationischer Reaktionen bekannt zu machen. Zahlreiche chemische Reaktionen laufen nur ungehemmt ab (meist solche, bei denen keine Übergangsmetalle anwesend sind), . ὀξύς oxys „scharf, spitz, sauer“ und γεν- gen- „erzeugen“) ist ein chemisches Element.Warum ist das sauerstoffmolekül ein unpolares Molekül? Wenn zwei Sauerstoffatome hingegen untereinander zwei gemeinsame Elektronenpaare für die Atombidung nutzen, erreichen beider wiederum eine abgeschlossene Schale. Wenn ein Stern wie unsere Sonne sein Lebensende erreicht, kann er die umliegenden Planeten und Asteroiden, die mit ihm geboren wurden, in sich aufnehmen. oxidativen Stress eine Rolle.
Was ist ein radikal?
Etwas Besseres ist noch nicht erfunden. Enthält ein Radikal mehrere ungepaarte Elektronen, spricht man von Diradikal (auch Biradikal), Triradikal usw.In diesem Video geht es um Umlagerungen.4 Radikale in biologischen Systemen. Reaktive Sauerstoffspezies (engl. Sie haben höhere Schmelz- und Siedepunkte als Alkane.Sauerstoff selbst ist zwar ein Diradikal, reagiert aber bei Raumtemperatur nicht mit Kohlenwasserstoffen, . Das erklärt die Wirkungen von Vitamin C, die dosisabhängig unterschiedlich sein können.Man könnte dahinter ein ’stabiles Radikal‘ vermuten – ähnlich wie im Artemisinin.Spätestens beim Sauerstoff hört der Spaß auf.
Reaktive Sauerstoffspezies

(02:39) Wasser (H2O) Lewis Formel. Den Film habe ich in 6 Abschnitte .Das Resultat ist, dass dieses Molekül relativ stabil ist, aber die Oktettregel nicht erfüllt. Hauptgruppe und bildet mit fast allen Elementen des Periodensystems stabile Oxide.Als Radikale bezeichnet man Atome oder Moleküle mit mindestens einem ungepaarten Elektron, die meist besonders reaktionsfreudig sind. Denn das Sauerstoffmelekül ist ein Diradikal, entält also 2 ungepaarte Elektronen.stoff den gewöhnlichen Sauerstoff, ein Diradikal mit zwei ungepaarten Elektronen (Gesamtspin S = 1/2 + 1/2 = 1, Spinmultiplizität 2 S + 1 = 3) als Triplett-Sauer-stoff 3 O 2 von dem Singulett-Sauerstoff 1 O 2 . Silicate, Carbonate) ist Sauerstoff das häufigste Element der Erdkruste. Sauerstoff als Diradikal greift hierbei die besonders aktivierte benzylische Position des Cumols an: dabei bildet sich ein tertiäres benzylisches Radikal I, welches sich mit dem Luftsauerstoff zum Peroxyradikal . Medizinischer Sauerstoff ist ein medizinisches Hilfsmittel, das reinen Sauerstoff in einer konzentrierten Form liefert, die unter ärztlicher Aufsicht verwendet werden kann.Ich weiß nicht, wer es sagte, vielleicht Einstein, sicher nicht Konfusius: Man sollte die Dinge so einfach wie möglich darstellen, aber nicht einfacher.
- Warum Schießt Der Salat? _ Warum schießt Salat?: Labertaler Fachmarkt
- Warum Ist Punta Cana Eine Der Besten Sehenswürdigkeiten In Der Karibik?
- Warum Sind Narzissten So Wichtig Nach Der Scheidung?
- Warum Ist Jugendsprache So Beliebt
- Warum Ist Katar Nicht Für Die Weltmeisterschaft Geeignet?
- Warum Macht Man Eine Inventur?
- Warum Sind Menschen Auf Der Erde Von Wasserknappheit Betroffen?
- Warum Sind Bäume In Naturschutzgebieten Verboten?
- Warum Ist Die Osterinsel So Wichtig?
- Warum Ist Turnen Im Kindergarten So Wichtig?
- Warum Sind Nori-Blätter Giftig?
- Warum Knurrt Der Darm , Darmgeräusche
- Warum Ist K-Pop So Populär? , Warum ist K-Pop so beliebt? (Musik, Lied, Asien)
- Warum Leckt Sich Eine Hündin Ständig Im Genitalbereich?