Stoffmenge Berechnen Übungen Pdf
Di: Samuel
Lokalextrempunkte liegen in der Nähe des betrachteten Punktes, Globalextrempunkte für .Lerne Schritt für Schritt, wie du Mol, molare Masse, Stoffmenge und Teilchenzahl berechnest. Lösungen: Zu Aufgabe 1: 1.

Lösungen: Die Molare Masse M ist der Quotient aus einer konkreten Masse m (Stoffportion) und der Stoffmenge n: M = m/n.

M (F) = 19 g/mol. Übungen mit lösungen zur Chemie Reaktionsgleichungen. Berechne die Stoffmengenkonzentration. Unten findet ihr ein paar Beispielaufgaben, die euch beim Bearbeiten der Aufgaben helfen können. Schritt: Berechnen Sie die Masse einer bestimmten Stoffmenge anhand der Stöchiometrie. Molare Massen der Ausgangs- und Endstoffe: 46 g/mol 36 g/mol 2 g/mol 80 g/mol. Berechnen Sie für diese Lösung den Massenanteil w von Saccharose. Die AVOGADRO-Konstante N A beträgt 6,022 14 ⋅ 10 23 m o l − 1. Welche molare Masse M hat Wasser?. Extrempunkte (englisch critical points) sind Punkte einer Funktion, an denen sich die Tangente der Funktion nicht mehr ändert, wenn man den Punkt weiterbewegt. 500 ml Lösung enthalten 1 g Kaliumnitrat (KNO 3).Vorgehensweise zur Berechnung von Stoffumsätzen bei chemischen Reaktionen. Titel wpd pdf Übersicht Klasse 9; mV Fragen zur Salzsäure : 01. So enthalten z. 5 g Natriumhydroxid werden in Wasser gelöst und die Lösung mit Wasser auf 500 ml aufgefüllt. Bei der Reaktion von Natrium mit Wasser sind die Reaktionsteilnehmer Natrium, Wasser und Wasserstoff wie folgt beteiligt: m (Na) = 0,184 g , m (H2O) = 0,144 g und V (H2) = 89,6 mL bei Normbedingungen. Aufgaben zur Chemie Reaktionsgleichungen. In diesem Artikel lernst du wie man den Stoffumsatz von Reaktionen mit Produkten berechnet. (e) im Toten Meer 200 – 260 g Kochsalz.Bruchteile berechnen und Bruchteile bestimmen.2020; Bildungsgang Allgemeine Hochschulreife; Fach Chemie; Klassenstufen 10, 11, 2. Außerdem gehen wir auf die Bedeutung der Stoffmengenkonzentration ein.) Berechnen Sie die Stoffmenge folgender Stoffportionen! a) 0,118 mg AgCl b) 6,59 g H 2O c) 0,333 µg HgSO 4 d) 90,8 mg CO 2 e) 0,008 mg Ra f) 52,45 g Ar g) 5,0 g Au h) 2,23 kg B 2O3 3. Die Stoffmenge n ergibt sich aus der obigen Beziehung als Quotient von . Dementsprechend ist die Stoffportion m das Produkt aus Molarer Masse M und Stoffmenge n: m = M*n. Die Stöchiometrie liefert dir also Informationen zu den Mengen- und Ladungsverhältnissen . Diese Aufgaben können dir helfen, das Thema besser zu . Stoffmenge: Wasserstoff Berechnen Formel Einheit Definition StudySmarter Original! Begründen Sie, dass während der Zustandsänderung von (1) nach (2) Wärme zugeführt werden muss. Es gilt n(I2)= n(Na2 SO3) 2. 0,33 mol Wasser haben die Masse m = 5,94 g. Bestimme die Stoffmengenkonzentration der Natronlauge. · 1 kmolO 2 = 1kmolH 2 O (1) Durch Umrechnung der Stoffmengen mit den Molmassen ergeben sich folgende Massenbilanzen: 2 kgH 2 + 1 2.M (Si) = 18 g/mol. Wie groß ist die Stoffmenge in mol, wenn die Masse des Stoffes 30 g beträgt? Stoffmenge = 30 g / 2 g/mol = 15 mol. H+ steht für H+ (aq) = H 3 O + (aq)! Ammoniak + Fluorwasserstoffsäure ⇌ Ammoniumfluorid + Wasser NH 4 + + OH− + H+ + ⇌F− NH 4 F (aq) + H 2 O Natronlauge + Fluorwasserstoffsäure ⇌ Natriumfluorid + Wasser
Extrempunkte berechnen Übungen Aufgaben
Stöchiometrie wird auch als chemisches Rechnen bezeichnet. Ein ideales Gas durchläuft den im V(T)-Diagramm dargestellten Kreisprozess.
Mol (molare Masse) berechnen: Aufgaben mit Lösungen
Durch die Mol-Angabe weißt du immer, mit wie vielen Teilchen eines Stoffes du gerade arbeitest — bei einem Mol sind das genau 6,02214076 1023 Teilchen. Die Atomare Masseneinheit u hat den Wert 1,660 54 ⋅ 10 − 27 k g. Berechnen Sie den NERNST‘schen Verteilungskoeffizient K = cES/cER auf 2 . Die Stoffmenge und Masse eines Stoffes lassen sich also über die molare Masse ineinander umrechnen.4) Welche Stoffmenge entspricht einer Eisenportion der Masse 1 g? Wie viele Eisenatome sind in dieser Stoffportion enthalten? 11 g Eisen entspricht einer Stoffmenge n (Fe) = 0,0179 mol und 0,1078 • 1023 Fe- Atomen.1 10 Gramm NaCl entsprechen 0,1711098 mol NaCl. Die molare Masse M von Wasserstoffchlorid ist 36,5 g/mol.Übungsaufgaben.Die Stöchiometrie ist ein mathematisches Hilfsmittel zur Bestimmung der mengenmäßigen Beziehungen bei chemischen Reaktionen.Siehe dazu auch Übung zum Rechnen mit der Molzahl im pdf-Format und Übung zum Rechnen mit der Molzahl im WordPerfect-Format. Aufstellung der Reaktionsgleichung: 2 Na (s) + 2 H 2 O (l) —-> H 2 (g) + 2 NaOH (aq) 2. – Wie bestimmen die Stoffmenge n der abgewogenen Masse: n = m : M = 73 g : 36,5 .Die folgenden Aufgaben sollen in Gruppenarbeit bearbeitet werden.
Arbeitsblatt
Es gilt: n = \dfrac {m} {M} n = M m. Aufgaben mit Lösungen Stöchiometrie Klasse 9 . Durch stöchiometrische Rechnungen können die Stoffmengen, Massen und Volumen von Edukten und Produkten mithilfe der Reaktionsgleichung berechnet werden. Die Formel hierfür lautet: Mit: = Partialdruck der i-ten Sorte; Schauen wir uns einmal die Berechnung am Beispiel der Ammoniaksynthese im Haber-Bosch-Verfahren genauer . um sich die atomaren Verhältnisse besser vorzustellen, die Anzahl an Teilchen in einer gewissen Stoffportion berechnen.Übungsaufgaben Klasse 9.
Arbeitsblatt
Dabei ist sie nicht als Anzahl der Teilchen oder Masse festgelegt, sondern definiert durch die Teilchenanzahl in einem Mol. n(Na 2 SO 4) berechnet man mit der Grundformel: Das erhaltene Ergebnis setzt man in (Gl.Stöchiometrische Berechnungen. Ein einatomiges ideales Gas der . 1) ein: Antwortsatz: In 100g Na 2 SO 4 sind 0,704mol Schwefel-Atome . Es sind mehr als ihr in der vorgegebenen Zeit schaffen könnt, sucht euch also einfach die Aufgaben aus, die zu eurer Gruppe passen. Schüttelt man dieses Gemisch mit 100 mL Tetrachlormethan aus, so verbleiben im Gleichgewichts-zustand in der wässrigen Phase 3,5 mmol Isopropanol, in der CCl4-Phase sind 65,2 mmol Isopropanol zu finden.

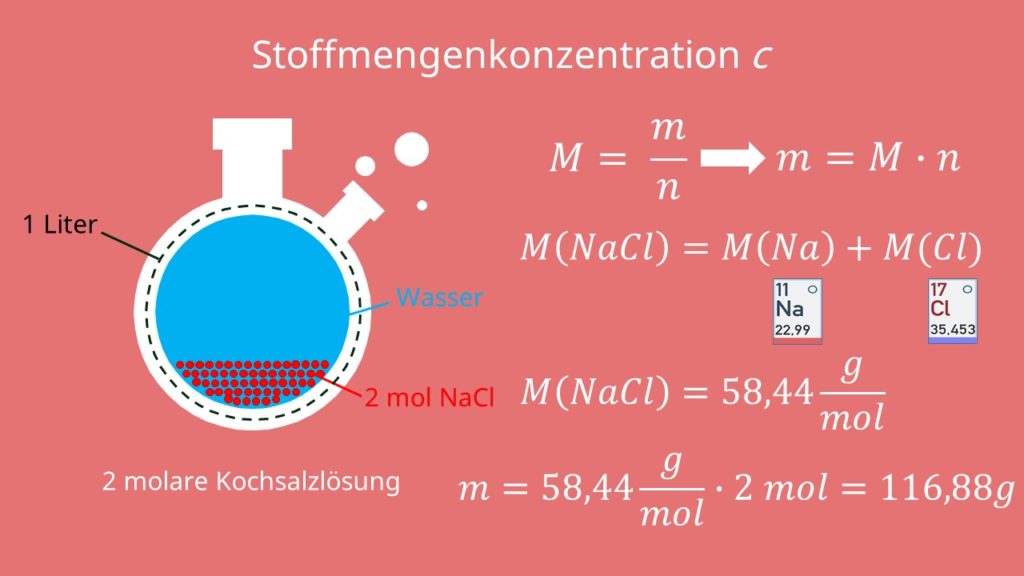
Reaktionsgleichungen sind eine mathematische Notation, die es ermöglicht, . Mol gibt dir sozusagen die „Verpackungsgröße“ für eine bestimmte Anzahl .Aufgaben Kreisprozesse. Bearbeite schriftlich folgende Aufgabe: 1. Titel Übungsaufgaben Stöchiometrie – Teil 1; Autor Birgit Lachner; veröffentlicht 30. Dabei ergibt sich: 35,45 g/mol + 22,99 g/mol = 58,44 g/mol.Um die Masse des addierten Iods zu berechnen, wird zunächst die Stoffmenge benötigt.Atomare Größen. Berechnen Sie den idealen und realen Druck von 2,5 mol Methan (a = 2,25 L2⋅atm⋅Mol-2; b = 0,0428 L ·Mol-1) in einem 10 L Behälter bei einer Temperatur von 75° C. Es ist nämlich die Einheit der Stoffmenge (Symbol n ). Berechnen Sie die folgenden Aufgaben: Die molare Masse von Wasserstoff (H 2) beträgt 2 g/mol. a) Bei 20 °C lösen sich 197 g Saccharose in 100 mL Wasser.Die Formel zu Berechnung der Stoffmenge lautet: n = m : M (Stoffmenge n ist der Quotient aus Masse m und molarer Masse M.Extrempunkte berechnen.Hier erfährst du, wie die ursprünglich zwei Faraday’schen Gesetze formuliert wurden und wie das Gesetz in der heutigen Zeit formuliert wird. Die absolute Atommasse m A ( X) ist die Masse eines Atoms in k g.Dadurch, dass die Masse und die Stoffmenge in einem bestimmten Verhältnis zueinanderstehen, konntest du mithilfe der Berechnungen den passenden Salzkristall auswählen. Diese ergibt sich aus der Hälfte der Stoffmenge von Natriumthiosulfat (da pro Umsatz eines Iodmoleküls zwei Thiosulfatsmoleküe notwendig sind). Wie das geht, sehen wir uns im Folgenden an. Aufgaben mit Lösungen Stöchiometrie Klasse 9.Herunterladen Als PDF Herunterladen. Es ist bekannt: Skizzieren Sie das zugehörige p(V)-Diagramm und markieren Sie die Zustände (1) bis (4). b) Wie viel Prozent Eisen sind in Eisen(III)-oxid (Fe. Lösungen – ohne Gewähr. Hierzu findest du viele Arbeitsblätter online. Größenbezeichnungen, die benötigt werden: Formelzeichen Einheit Molare Masse M g/mol ; [unit] Masse m g Stoffmenge n mol Volumen V l molares Volumen Vm 22,4 l/mol Avogadrokonstante Na 6, 022 * 1023 1/mol Teilchenanzahl N Teilchen 1 l (Liter) = 1 dm3 Formeln: M = m/n ( Molare Masse ist .) Berechnen Sie die folgenden Molmassen! a) [Cu(NH 3) .
Massenwirkungsgesetz · Aufgaben & Lösungen · [mit Video]
Berechne die Kochsalzkonzentrationen in mol/l für die fünf Meeresge-biete. M (C) = 12 g/mol. Gehaltsbestimmung .
Stöchiometrie • Chemie, Aufgaben, Formeln · [mit Video]
Teilchen können hier Atome, Ionen, Moleküle, Formeleinheiten oder auch Elektronen sein.

Die Ergebnisse der Aufgaben können dann gruppenweise präsentiert und im Plenum diskutiert werden. Die Berechnungen können vereinfacht werden, indem statt der Konzentration die Stoffmengen in das Massenwirkungsgesetz eingesetzt werden, da die Volumina bei der Reaktion konstant sind. In diesem Artikel findest du verschiedene Aufgaben zur Stöchiometrie mit Lösungen. Wären dir andere Größen über die Salzkristalle und die empfohlene Salzmenge zum Nudelkochen bekannt gewesen, hättest du auf viele unterschiedliche Weisen . Es folgen 10 Aufgaben zu Masse-Masse Berechnungen im Wechsel mit den Lösungsfolien. 1) ) Man kann zunächst n(Na 2 SO 4) ausrechnen und dann über (Gl.Stoffemengenkonzentration: Quotient aus der Stoffmenge n(B) des gelösten Stoffes B und dem Volumen der Lösung (=Gesamtvolumen nach dem Mischen bzw. 1) n(S) bestimmen. Es lassen sich unter anderem die Verhältnisse von Elementen in Verbindungen und rechnerische Größen bestimmen.1 kmolH 2 + 1 2. Wir starten mit Bruchteilen.Öffnen – Lösungen PDF. Kochsalz (NaCl; MNaCl = 58, 44 g/mol) ist im Meerwasser in großen Men-gen vorhanden.Stoffmenge an Schwefelteilchen genauso groß wie die Stoffmenge an Na 2 SO 4-Teilchen: (Gl. 1 m o l eines Stoffes besteht aus 6,022 14 ⋅ 10 23 Einzelteilchen. Lösungen zu den Übungen zu Neutralisationen Ergänze. Ein Mol eines Stoffes enthält immer die exakt selbe Menge an Teilchen (Atomen oder Molekülen) – nämlich 6,02214076⋅10236,02214076 cdot10^ {23}6,02214076⋅1023 Teilchen. Das Wichtigste auf einen Blick. In den Tabellen (M 3 und M 6) sind entsprechende Enthalpien zur Berechnung der verschiedenen Aufgaben dieses . Anschließend soll begründet werden, auf welcher Seite sich .Übungsaufgaben zur Stoffmengenkonzentration.Man unterscheidet hierbei zwischen Lokal- und Globalextrempunkten. Welche Masse m hat diese Portion Eisessig?.
Mol • einfach erklärt: Berechnung, Umrechnung · [mit Video]
Übung zum Rechnen mit der Molzahl
Titration, Maßanalyse, Volumetrie: Bestimmung der Stoffmenge eines gelösten Stoffes mit Hilfe einer Lösung bekannter Konzentration (Titer, Maßlösung). Berechnen Sie die Korrekturfaktoren für Druck und Volumen von 1 Mol CO2 im Norm-zustand (a = 3,64 L2⋅bar⋅Mol-2, b = 0,0427 L ·Mol-1). Stöchiometrie und chemisches Rechnen.
Uebungsaufgaben
Ein Mol dient unter anderem der Mengenangabe in chemischen Reaktionen. Bei chemischen Reaktionen ist es in der Regel so, dass ein Edukt verschwindet oder sich ein Produkt neu bildet.
Stoffmenge
1 Berechnung der .Bewertungen: 3
Übungen zur Stoffmengenkonzentration
Wie viele Quecksilber-Atome sind in 0,3 mol Quecksilber enthalten? Ein Zehnpfennigstück hat den Durchmesser 16,0 .Aufgabe 3: In dieser Aufgabe sollen die SuS konkret die Gleichgewichtskonstante K berechnen. Die Einheit der Stoffmenge ist das Mol, eine SI-Basiseinheit. 1000 g Meerwasser. M(B): Molare Masse des gelösten Stoffes B; m(B): Masse des gelösten Stoffes B; n(B): Stoffmenge des gelösten Stoffes B . Ausbildungsjahr; Um die Lizenzinformationen zu sehen, klicken Sie bitte den . Dazu müssen wir einfach die von Chlor und Natrium addieren.Übungsaufgaben zu Stoffmengen und -portionen chemischer Reaktionen. Außerdem zeigen wir dir, wie du die Gesetzmäßigkeit anwenden kannst.Stöchiometrie Übungen (m/m) Slide. Die Stoffmenge ist also der Quotient aus Masse und molarer Masse eines Stoffes. In 100 mL Wasser wurden 68,7 mmol Isopropanol gelöst.Übungen zur Allgemeinen Chemie im Nebenfach .Aus dem Periodensystem der Elemente können wir die molare Masse (M) von Kochsalz entnehmen. Sie beschreiben, wie chemische Reaktionen ablaufen.Für die Berechnung der Stoffmengenkonzentration benötigst du die Stoffmenge .Kapitel 13: Chemisches Rechnen 4 Berechnung der Teilchenzahl aus der Stoffmenge Manchmal möchte man, z.Massenwirkungsgesetz in der Gasphase. Bei der Titration lässt man so lange Titrierflüssigkeit zu der Probe zutropfen, bis sämtliche Ionen der Probe durch . Der Umgang mit Stoffgrößen wie Masse, molare Masse und Stoffmenge wird hier nicht eingeübt, sondern vorausgesetzt. Das Mol ist die international anerkannte Einheit der Stoffmenge. einfach: mittel: schwer: Abschlusstest. Für ein besseres Verständnis ist das Faraday Gesetz im Video noch anschaulicher mit Bild und Ton dargestellt.
Faradaysche Gesetze · Elektrolyse, Gleichung · [mit Video]
Die Stöchiometrie ist ein wichtiges mathematisches Hilfsmittel in der Chemie.
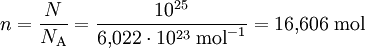
Die Chemie Reaktionsgleichungen sind ein wesentlicher Bestandteil der Chemie.Die Stoffmenge (veraltet Molmenge oder Molzahl) mit dem Formelzeichen n ist eine Basisgröße im Internationalen Einheitensystem (SI) und gibt indirekt die Teilchenzahl einer Stoffportion an. Dabei kannst du in der Regel auf 6,022 10 23 runden. Beispiel: – Wir wiegen eine Masse m = 73 g Wasserstoffchlorid (HCl) ab.Berechnungen mit Stoffmenge, Masse und molarer Masse. Mol, molare Masse, Stoffmenge: https://youtu.
Wie der Name schon sagt, gibt dir die Stoffmenge die Menge eines Stoffes an. Das ist mit der Avogadro Zahl nicht schwer.

Chemisches Rechnen
Hinweis: Bei einigen Aufgaben finden sich nur kurze Lösungshinweise. Auf dieser Seite kannst du: Dazu kannst du viele Arbeitsblätter online bearbeiten oder als PDF herunter laden und auf dem Tablet-Computer mit einem Stift bearbeiten oder ausdrucken und klassisch bearbeiten. Die Stoffmenge des Natriumthiosulfats lässt sich aus der Konzentration und 5) Es sollen 100 ml einer Fe3+ -Lösung der Stoffmengenkonzentration c (Fe3+) = 1 mol/l hergestellt werden.Berechne die Stoffmenge n von 100 g Disauerstoff O 2. · 32 kgO 2 = 18kgH 2 O (1) 1 kgH 2 + 8kgO 2 = 9kgH 2 O (1) Für den Wasserstoffanteilheines Brennstoffes folgt daraus: hkgC kgB. einfach: mittel: schwer: Zurück zur Übersicht Was sind die Stoffmenge und das Mol? Premium Funktion! Und nu? Kostenlos registrieren und 2 Tage Stoffmenge und molare Masse .Maßanalytische Verfahren, Durchführung und Auswertung von Titrationen Grundlagen. e) Na 2CO 3 f) Ca(HCO 3)2 2.be/eFHG4xuh4GY
Stöchiometrie Aufgaben Mit Lösungen Klasse 9
Schließ dich über 22 Millionen Schülern und Studierenden an und lerne mit unserer StudySmarter App! Die erste Lern-App, die wirklich alles bietet, was du brauchst, um deine Prüfungen an einem Ort zu meistern. Gegeben sind 0,55 mol Eisessig CH 3 COOH.Übungsaufgaben zur Titration 1. Grundwissen Aufgaben. Inhaltsübersicht.

Alle Ionen sind grundsätzlich in Wasser gelöst. Da man nun die Molare Masse M sowie die Masse m der Stoffprobe kennt, kann man nun die Stoffmenge (n) berechnen.Tutorium zur Analytischen Chemie Übungsaufgaben 1 1. Zur Berechnung der Gleichgewichtskonstante werden bei Reaktionen in der Gasphase die Partialdrücke als Parameter genutzt. Vergleichen Sie diese mit den aus Ausbildungsjahr, 3.pdf: Arbeitsblätter F olien L ehrplan L ern- und methodische Hinweise R eferate T exte V ersuche und -ergebnisse Hinweise zum Ausdrucken mV: mobile Version mit Lösungen: mV Übungen zur Dichte : 02. a) Welche Stoffmenge an Wasserstoff-Ionen ist in 25 ml . Stoffmenge, Molmasse, Molvolumen .
Stöchiometrische Berechnungen
- Still Pyjama Baby : Stillpyjamas
- Stolberg Hauptbahnhof _ Bahnhof Stolberg-Hammer
- Straßenkarte Höxter , Das sind nach der Flut die größten Gefahren für die Straßen im Kreis Höxter
- Stoffschere Prym – Die besten Stoffscheren Prym
- Still Pille : Die Pille • Sorten, Kosten, Nebenwirkungen
- Stocker Wikipedia : Herbstmilch (Film)
- Stralsund Deutschlandkarte , Die 10 besten Hotels am Strand in Stralsund, Deutschland
- Stiftung Warentest Mittel Gegen Schwindel
- Stiftung Finanztest Festgeld : Festgeld: Zwei neue Zinsbetrüger auf unserer Warnliste
- Story Mode Tekken 7 | Online Modes