Sekundärstruktur Eines Proteins
Di: Samuel
Zwei der Hauptelemente in der Sekundärstruktur eines Proteins sind die α-Helix und der β-Strang.Peptide und Proteine bestehen aus Aminosäuren, die während der Proteinbiosynthese (Translation) durch Peptidbindungen miteinander verknüpft werden. einer Untereinheit . Sie ist durch die Primärstruktur der Einzelbausteine und Wasserstoffbrückenbindungen bestimmt, die sich zwischen nicht benachbarten . Neben der α-Helix und dem β-Faltblatt existieren weitere Arten von Sekundärstrukturmotiven. In der α-Helix ist die Polypeptidkette zu einem dicht verdrillten Stab gepackt.Polypeptide können mehrere helikale Konformationen ausbilden. Die Proteinstruktur lässt sich auf vier Betrachtungsebenen beschreiben: Als Primärstruktur . Stabilisiert wird diese räumliche Gesamtstruktur sowohl durch kovalente als auch durch nicht kovalente Wechselwirkungen: . die Helixstrukturen doppelsträngiger Desoxyribonucleinsäuren und Ribonucleinsäuren . Jedoch ist die Peptid-Bindung mesomerie-stabilisiert, was zur Bildung einer partiellen Doppel-Bindung mit ein- .Bei einem Protein mit mehreren Untereinheiten, liegt eine Quartärstruktur vor, die durch Wechselwirkungen eine bestimmte Gesamtstruktur einnimmt. Tertiärstruktur – die räumliche Struktur des einzelnen Proteins bzw.Sie erfüllen wichtige Funktionen in der Anatomie und Physiologie . β-Stränge Pfeile mit einer Dicke von 25 % der Breite in Richtung von N-zu C-Terminus.Faserproteine, Gerüstproteine, Scleroproteine, fibrilläre Proteine, Proteine, die weitestgehend aus einem Sekundärstruktur-Typ (α-Helix oder β-Faltblatt) aufgebaut sind und deren Polypeptidketten durch lange Stränge oder faltblattartige Strukturen gekennzeichnet sind. Sekundärstruktur – die räumliche Struktur eines lokalen Bereiches im Protein (z.Abbildung 12: Tertiär- und Sekundärstruktur (im Bild unten rechts) einer tRNA Tertiärstruktur der Proteine Die Tertiärstruktur der Proteine ist eine asymmetrische, dreidimensionale Anordnung, die teilweise α-Helix- und β-Faltblattstrukturen beinhaltet. Bei den Proteinen wird wird von 4 unterschiedlichen Strukturebenen unterschieden, der Primärstruktur, Sekundärstruktur, Tertiärstrukturund Quartärstruktur. Einige Proteine setzen sich aus mehreren Polypeptidketten .
Proteinstrukturvorhersage
![Proteine • Aufbau und Funktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/08/WP_Proteine_1-1024x576.jpg)
Primärstruktur
Proteine im Stoff- und Energiewechsel einfach erklärt: Definition Aufbau Struktur Funktion Nachweis Video – simpleclub BiologieEiweiße (mehr als 100).Primärstruktur – die Aminosäuresequenz der Peptidkette. Proteine, Eiweiße, ausschließlich oder überwiegend aus Aminosäuren aufgebaute makromolekulare Verbindungen, die entscheidender Bestandteil der lebenden Materie sind. Die Struktur wird aus vier Blickwinkeln betrachtet: Der Primärstruktur, Sekundärstruktur, Tertiärstruktur.Als Sekundärstruktur bezeichnet man die relative Anordnung der Einzelbausteine ( monomere Bausteine) von biologischen Polymeren wie Nukleinsäuren, Proteinen oder Polysacchariden. Der Fokus liegt dabei auf dem Polymerrückgrat, auch Backbone genannt. Sie ergibt sich aus der praktischen Schwierigkeit, die . Die Biosynthese erfolgt vom C zum N-Terminus. Die Primärstruktur bestimmt die Sekundär-, Tertiär- und Quartärstruktur. Die Sekundärstruktur eines Proteins beschreibt räumliche Struktur-elemente, die sich regelmäßig wiederholen. Quartärstruktur – die räumliche Struktur des gesamten .
M3: Struktur von Proteinen
Auf den ersten Blick liegen nur frei drehbare Einfach-Bindungen in der Haupt-Kette vor (Abb.Elemente der Sekundärstruktur sind dennoch nicht sehr gut erkennbar. die Abfolge (Sequenz) seiner Grundbausteine. Da die Gesamtstruktur von Peptiden sehr komplex ist, unterteilt man sie zur vereinfachten Betrachtung modellhaft in vier Ebenen, die Primär-, Sekundär-, Tertiär- und Quartärstruktur. Aminosäuren sind durch Peptidbindungen miteinander verbunden, die die Aminogruppe einer AS mit der Carboxylgruppe der nächsten AS verbinden, wodurch die .
Räumliche Anordnung von Proteinen
Bändermodell (Proteine)
Sekundärstruktur. Primärstruktur > Sekundärstruktur > Tertiärstruktur > Quartärstruktur
Der räumliche Aufbau von Proteinen
Nur die Alpha-Helix besitzt jedoch starke, stabilisierende Wasserstoffbrückenbindungen. Makromoleküle – Aminosäuren – Eigenschaften – Peptide – Primärstruktur – Sekundärstruktur – Tertiärstruktur – Beeinflussung – Quartärstruktur. β-Faltblätter bestehen aus parallel angeordneten β-Strängen mit β-Schleifen. Sie entsteht durch eine Kondensationsreaktion zwischen der Aminogruppe einer und der Carboxygruppe einer anderen Aminosäure. Die nicht zu einem Motiv gehörenden Teile der Primärstruktur eines Proteins werden Zufallsschleifen (Random-Coil-Strukturen) genannt.Als α-Helix oder alpha-Helix bezeichnet man in der Biochemie eine geordnete Sekundärstruktur (ein Faltungsmuster) innerhalb eines Peptids oder Proteins. Die molekularen Ursachen für diese Regel-mäßigkeit sind die Wasserstoffbrücken, die zwischen der C O- und der N — H-Gruppe
Sekundärstrukturen
2) Wodurch wird die Sekundärstruktur eines . nach der Translation eines RNA-Moleküls werden die Sekundärstruktur und die höheren Strukturebenen des Proteins ausgebildet.
Proteine: Peptidbindung und Proteinstruktur
Die Tertiärstruktur eines kleinen Proteins Quelle: Wikipedia, Artikel Protein structure , abgerufen im Mai 2013, Autor: nicht mehr bekannt, Lizenz: public domain .
Sekundärstruktur
Primärstruktur > Sekundärstruktur > Tertiärstruktur > Quartärstruktur. Die bei dieser Verknüpfung entstehende Bindung heißt Peptidbindung. Die Konformation der Seitenketten und ihr Verhältnis zu anderen Elementen werden außer Acht gelassen. Die Konfirmation beschreibt hierbei die genaue Struktur eines ganzen Proteins und wird durch die Primär-, Sekundär-, Tertiär- und Quartärstruktur beschrieben.
Lehrbuch der Biochemie: Biomoleküle: Proteine
Die Struktur wird durch Wasserstoff-Brücken zwischen den Carbonyl- und Amino-Gruppen der nebeneinander-liegenden Ketten . Unter Primärstruktur versteht man in der Biochemie die unterste Strukturebene eines Biopolymers, d. enthalten und im menschlichen Organismus finden sich mehr als .
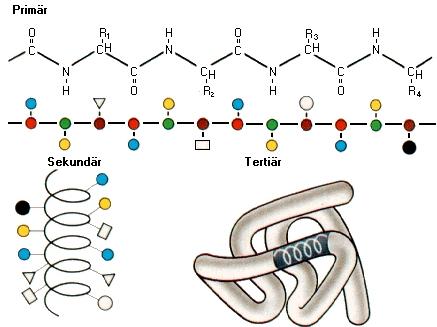
Merke: Eine regelmäßige Faltung bildet dabei die Sekundärstruktur aus.
Proteine
Hugo Theorell entdeckte Myoglobin 1932 in Schweden.Die Tertiärstruktur eines Proteins entsteht durch erneutes Verbinden der Polypeptidkette in der Sekundärstruktur. Sekundärstruktur (β-Faltblatt links, α-Helix rechts), Tertiär- und Quartärstruktur.Proteinstrukturvorhersage.
Struktur von Proteinen
α-Helices machen einen hohen Prozentsatz der Sekundärstruktur des Myoglobins aus.
Peptide und Proteine
Proteine haben mindestens drei Strukturen: Primär-, Sekundär- und Tertiärstruktur. Am Aufbau von Proteinen sind 20 verschiedene Aminosäuren beteiligt. Diese Strukturen werden als Sekundärstruktur eines Proteins bezeichnet.Sekundärstrukturen.Die Drehbarkeit der Bindungen in einem Protein hat einen großen Einfluss auf dessen dreidimensionale Struktur, die so genannte Konformation.Die Tertiärstruktur beschreibt die dreidimensionale Struktur eines Proteins und entsteht durch die Verwindung der Sekundärstruktur. Typische Sekundärstrukturen sind die schraubenförmige α-Helix (siehe Bild ) und das ziehharmonikaähnliche β-Faltblatt (siehe Bild ).Sekundärstruktur: Nahordnung des Polypeptidrückgrats: Helices, Faltblätter, Turns, Loops .Die Gesamtheit aller Proteine in einem Lebewesen, einem Gewebe, einer Zelle oder einem Zellkompartiment, .
Cytologie: Proteine
Jetzt gehen die Seitenketten der Aminosäuren Bindungen miteinander ein. Durch die (feste) planar Struktur einer Polypeptidbindung kann eine Kette aus Aminosäuren nicht gedreht werden, wodurch (durch die Wasserstoffbrückenbindung) eine räumliche Struktur ausbildet . Die Primärstruktur eines Proteins ist seine Polypeptidsequenz.1) Was versteht man unter der Primärstruktur von Proteinen und wie wird diese gebildet? a) Die Primärstruktur eines Proteins entsteht durch Verknüpfung der einzelnen Aminosäuren zu einem Makromolekül.Als Domänen werden einzelne Abschnitte eines Proteins bezeichnet, die sich aufgrund ihrer Raumstruktur von einem anderen Teil des Proteins unterscheiden lassen. Unter der Sekundärstruktur eines Proteins wird die räumliche Struktur der Aminosäurekette .
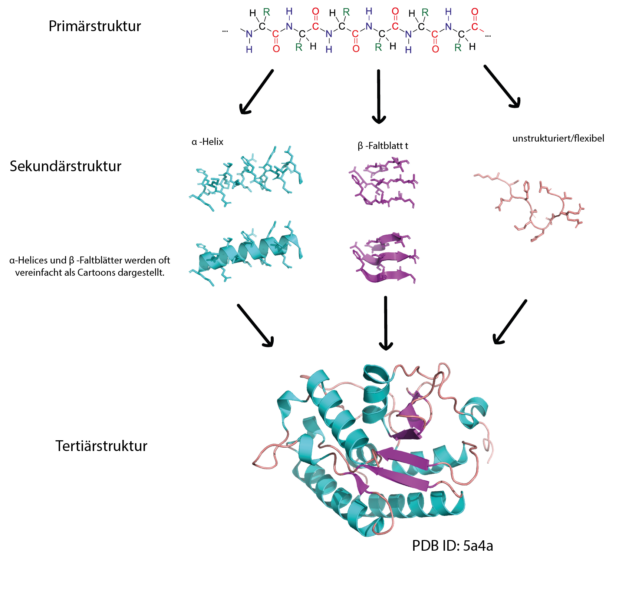
Nun gelangen wir zur höchsten Stufe, analog zum Buch, bei der Quartärstruktur.Sekundärstruktur; α-Helices Zylindrische spiralförmige Bänder, mit der Bänderebene ungefähr auf der Peptidbindungsebene. Eiweiße nehmen wir mit der Nahrung auf.Diese Proteine verbindet die Eigenschaft, dass sie einen kleinen Bereich besitzen, der mit dem jeweiligen Substrat interagiert. Im Körper werden die Eiweiße abgebaut und in die einzelnen Bauteile, die Aminosöuren zerlegt.Ein Protein (umgangssprachlich auch Eiweiße genannt) ist ein biologisches Makromolekül, welches durch die Verknüpfung von Aminosäuren entsteht.Strukturebenen eines Proteins Bei den Proteinen unterscheidet man vier Strukturebenen mit zunehmend Komplexität: Primärstruktur Sekundärstruktur Tertiärstruktur Quartärstruktur Die Primärstruktur Jedes Protein besitzt eine genau festgelegte Reihenfolge, in der die Aminosäure – Bausteine angeordnet sind. Es war auch das erste Protein, dessen räumliche Struktur . in einer Escherichia-coli -Zelle 3000 verschiedene P.Sekundärstruktur, im ursprünglichen Sinne diejenige Struktur von linearen Makromolekülen (makromolekulare chemische Verbindungen, Biopolymere), die ganz oder zu einem erheblichen Teil durch Wasserstoffbrücken bedingt ist, wie z. Die räumliche Struktur bedingt die Wirkungsweise der Proteine.Was versteht man unter einer Sekundärstruktur eines Proteins? Die Sekundärstruktur von Biopolymeren wie Proteinen, Nukleinsäuren und Polysacchariden beschreibt die relative Anordnung ihrer monomeren Bausteine.Im Fall der Aminogruppe spricht man vom N-terminalen Ende im Fall der Carboxygruppe vom C-terminalen Ende. α-Helix, β-Faltblatt ). Es besitzt eine molekulare Masse von ca. Diese nennt man proteinogen.Als Sekundärstrukturen werden in der Biochemie regelmäßige lokale Strukturelemente von Makromolekülen bezeichnet. Quartärstruktur – Bausteine
Was sind die vier Strukturebenen eines Proteins?
Manche Proteine wie Hämoglobin bestehen aus mehr als nur einer Polypeptidkette – die Struktur, die aus den Tertiärstrukturen mehrerer Polypeptidketten besteht, nennt man Quartärstruktur. Liegen mehrere davon vor, nennt man . Sie ist bestimmt durch die von Wasserstoffbrücken zwischen einzelnen Elementen definierten Topologie, sowie . Myoglobin ist ein monomeres Protein von 153 Aminosäuren. Faltung eines .
Strukturebenen der Proteine
Sekundärstruktur von NukleinsäurenPrimärstruktur des Proteins 1EFN und die daraus resultierenden höheren Strukturebenen. Findet nun eine inkorrekte .2010 1 Motivation Die Kenntnis der Struktur eines Proteins ist eine wichtige Grundlage für das Verständnis seiner Funktion. Dieser Proteinfaltung genannte Vorgang wird bei den meisten Proteinen u. Die Ausrichtung der Polypeptidketten kann parallel (in der gleichen Richtung) oder antiparallel sein.Proteine (Eiweiße) sind einer der 3 Makronährstoffe im Körper und werden aus einzelnen Bausteinen, den sogenannten Aminosäuren (AS), zusammengesetzt.Die Proteinstruktur ist in der Biochemie in verschiedene Strukturebenen gegliedert.Die Sekundärstruktur ist die lokale räumliche Struktur eines Proteins, die durch die Ausbildung von Wasserstoffbrücken zwischen den CO- und NH-Gruppen der Aminosäuren entsteht.Das β-Faltblatt ist eine gefaltete Sekundärstruktur der Proteine. Der restliche Teil des Proteins dient vorwiegend der Erhaltung der Struktur, der Beeinflussung der Wasser-/Fettlöslichkeit oder sie übernehmen regulatorische Funktionen für das Protein.
Einführung in die räumliche Struktur von Proteinen
Die Sekundärstruktur besteht aus der Helix (alpha-Helix) und dem Faltblatt (beta-Faltblatt), die aufgrund von Wasserstoffbindungen zwischen sich wiederholenden Elementen der Polypeptidkette .Dabei kommt es zu anziehenden Wechselwirkungen, die dafür sorgen, dass die Sekundärstruktur der Proteine ausbildet wird. Es bildet sich die Sekundärstruktur und Tertiärstruktur aus. Dabei wird Wasser abgespalten, es handelt .Als α-Helix wird in der Biochemie ein häufiges Sekundärstrukturelement eines Proteins bezeichnet. [1] In Bezug auf die räumliche Anordnung eines .Zwischen den ein-zelnen Aminosäuren wirken Kräfte und entstehen chemische Bindungen, die eine weitere Faltung des Proteins verursachen.
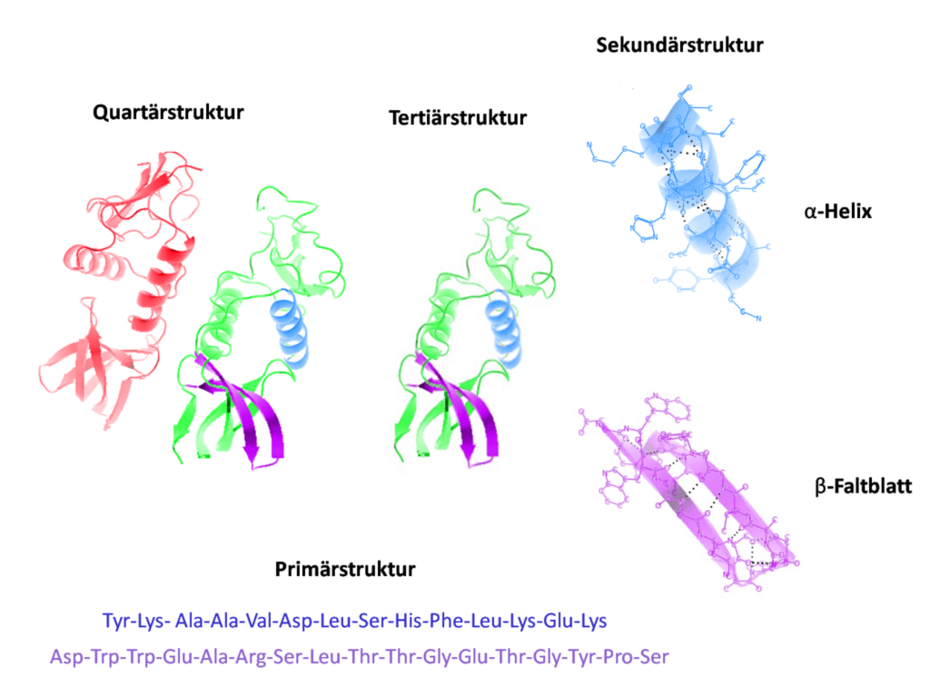
Die Bindungen erfolgen zwischen den Resten der Aminosäuren über verschiedene chemische Bindungen, wie Wasserstoffbrückenbindungen oder Elektronenpaarbindungen. Die Sekundärstruktur eines Proteins bezieht sich auf die räumliche Orientierung einzelner benachbarter Polypeptidketten, sowie deren Anordnung in bestimmten Faltungsmustern. Sie werden zwischen der Aminogruppe (NH) einer Aminosäure und der Carbonylgruppe (C=O) einer zweiten Aminosäure ausgebildet, die dazu dicht beieinander liegen müssen. Die Einteilung zu einer Hierarchie in Primärstruktur ( Aminosäuresequenz ), Sekundärstruktur, Tertiärstruktur und Quartärstruktur wurde erstmals 1952 von Kaj Ulrik Linderstrøm-Lang vorgeschlagen. Elemente der Sekundärstruktur sind Alpha-Helix (eine spiralige Anordnung ) und Beta-Faltblatt .
Primärstruktur (Proteine): Definition & Analyse
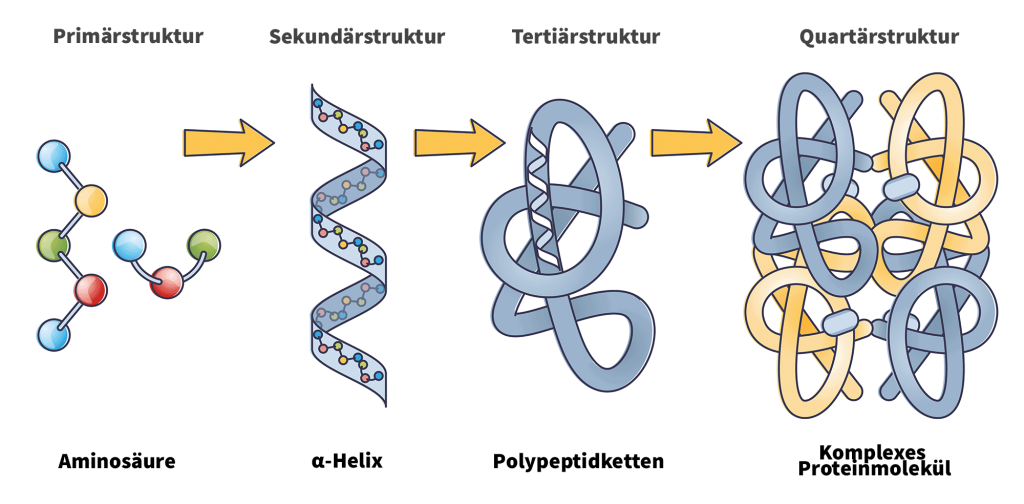
Beispiele für eine Quartärstruktur sind: Hämoglobin, Myoglobin und Kollagen. Bei einem β-Faltblatt legen sich Teile der Aminosäurekette längs nebeneinander, entweder parallel (gleichsinnig) oder antiparallel (gegenläufig). Analog zur kleinsten Einheit der deutschen Sprache in Form eines Satzes beginnen wir mit der Primärstruktur.Analyse der Sekundärstruktur von Proteinen mittels Infrarotspektroskopie Christian Zscherp, Andreas Barth, Suja Sukumaran und Karin Hauser überarbeitet von Annette Kopitz und Georg Wille, Stand: 01. Innerhalb der Helix ist die CO-Gruppe jeder Aminosäure über Wasserstoffbrücken mit der NH-Gruppe der viertnächsten Aminosäure in dem Strang .Step by Step Erklärvideo zur Struktur der Proteine.Proteine haben einem Amino (N)- und einen Carboxy (C)-Terminus (N-Ende und C-Ende). Betrachten wir die dreidimensionale Raumstruktur (Tertiärstruktur) eines kleinen Proteins; in der Wikipedia fand sich vor Jahren ein schönes Beispiel, das als public .Da Proteine aus Aminosäuren bestehen, wird ihre Primärstruktur Aminosäuresequenz genannt. Proteine und deren Struktureigenschaften Sekundärstruktur. Sie ist eines der wichtigen Ziele der Bioinformatik und der theoretischen Chemie. Sie gehört zu den stabilsten natürlichen Konformationen einer Peptidsequenz und ist in der Sekundärstruktur nahezu allgegenwärtig. Die Proteinstrukturvorhersage umfasst alle Methoden, rein rechnerisch aus der Aminosäuresequenz eines Proteins die dreidimensionale Struktur des gefalteten Moleküls zu ermitteln.In einem β-Faltblatt sind die Polypeptidketten verlängert, wobei Wasserstoffbrücken zwischen benachbarten Ketten gebildet werden.: Schleifen und andere
Tertiärstruktur: Definition & Strukturanalyse
Die Reihenfolge dieser Verknüpfung (AS1-AS2-AS-3) wird als Aminosäuresequenz bezeichnet. Andere wichtige Strukturelemente.

Chaperone unterstützt, geschieht bei kleinen Proteinen jedoch teilweise auch spontan.
Sekundärstruktur
Tertiärstruktur: dreidimensionale Struktur einer kompletten Polypeptidkette (Faltung) Quartärstruktur: Anordnung mehrerer (nicht kovalent verbundener) Untereinheiten .Die vier Strukturebenen eines Proteins Primärstruktur: Aminosäure-Sequenz Sekundärstruktur: Einteilung in • regelmäßig gefaltete Bereiche (Helizes, Faltblätter), • stabile Schleifen • unstrukturierte Bereiche dazwischen Tertiärstruktur: räumliche (3D) Faltung des Proteins, bestimmt durch die Koordinaten aller Atome Quartärstruktur: .Auf ähnliche Art und Weise sind Makromoleküle, wie Nukleinsäuren, aber auch Proteine, die universelle Aufgaben in Lebewesen übernehmen, hierarchisch aufgebaut. Die Struktur der Peptide und Proteine Da die Gesamtstruktur von Peptiden sehr komplex ist, unterteilt .Eine Peptidbindung entsteht durch die kovalente Verknüpfung der Carboxygruppe der einen Aminosäure mit der Aminogruppe der nächsten Aminosäure.Kompaktlexikon der Biologie Proteine.
- Segmüller Öffnungszeiten Weiterstadt
- Seealgenmehl Für Hunde | PerNaturam® Seealgenmehl für Hunde
- Sehwerte Bestimmen , Kontaktlinsen-Stärke
- Sehenswertes Am Rhein Entlang | Auf einen Blick
- Segregation In Education Activities
- Senckenberg Naturmuseum Besuchszeiten
- Seepferdchen Kindergarten Standorte
- Seegrundstück Kaufen Mecklenburg Vorpommern
- Seidentofu Prozentangaben _ Tofu richtig zubereiten
- Sehenswürdigkeiten Rund Um Bad Mergentheim