Reaktionsenthalpie Veresterung
Di: Samuel
Enthalpie Formel: Die allgemeine Formel der Enthalpie lautet: H = U + p ⋅ V.
Massenwirkungsgesetz
Die Veresterung von Acrylsäure und die Umesterung von Acrylsäureestern sind wirtschaftlich bedeutsame Reaktionen. Die Gesamtenergie der Produkte ist also geringer als die der Edukte. Außerdem benötigst du zwei Konstanten, die sogenannte Gaskonstante und den Frequenzfaktor . Gelegentlich findet sich dennoch die falsche Abkürzung NaAc (die .Veresterung Benzoesäure. Ihre Dämpfe wirken schon bei großer Verdünnung erstickend.
Klausuren Gymnasium
Organische Verbindungen – Typen, Eigenschaften und Reaktionen / Ester: Bildung und Spaltung. + Br 2 → C 2 H 5 Br + Br . Die Enthalpien vieler wichtiger Reaktionen wurden bei verschiedenen Temperaturen bereits experimentell bestimmt; diese genauen Tabellendaten sollte man, wenn vorhanden, für Untersuchungen guter Qualität auch nutzen. Für das Aufbrechen von Bindungen wird dabei Energie . Schwefelsäure . Es wird eine einstufige und eine zweistufige Betrachtung vorgenommen: Experimentelle Bestimmung (2-stufig): C + O 2 → C O 2 mit der Enthalpie: H R ( 1) = − 393, 5 k J m o l.Phthalsäureanhydrid ist ein brennbarer, jedoch schwer entzündbarer Feststoff aus der Stoffgruppe der Carbonsäureanhydride. durch Natriumhydroxid, oder durch spezielle Enzyme, die Esterasen.In diesem Artikel erfährst du mehr über den chemischen Bau des Essigsäure-Moleküls (Abb.
Natriumacetat
Aktivierungsenergie berechnen. Datum und Name des Studenten angeben. Gemäß Oberstufenlehrplan ist ein Großteil der Klausuren den Schwerpunktthemen Aromatische Kohlenwasserstoffe, Farbstoffe, Kunststoffe, Kohlenhydrate, Amino-säuren, Fette, Chemisches Gleichgewicht, Säure-Base-Reaktionen und Redoxreak-tionen gewidmet. Ein Gemisch aus FAMEs, das aus pflanzlichen (z. Δ R C p ergibt sich aus den molaren Wärmekapazitäten der an der Reaktion beteiligten Stoffe und den dazugehörige stöchiometrischen Faktoren. Die farblose Flüssigkeit ist ein charakteristisch „nach Klebstoff“ riechendes Lösungsmittel, das in der chemischen Industrie und in Laboratorien oft verwendet wird. Um die Veresterung im Detail erklärt zu bekommen, schau dir unser Video dazu an! In wässrigem Milieu können keine Alkoholate hergestellt werden, da das . -Radikal mit einem Bromatom eines Brommoleküls, sodass Bromethan und ein Bromradikal entstehen. Dann spricht man von der Standardreaktionsenthalpie \Delta {H}^0 ΔH 0. Herstellung von Acrylsäure.
Enthalpie: Definition, Einheit & Erklärung
Bei einem Gleichgewicht mit einer exothermen Hinreaktion verschiebt sich das Gleichgewicht bei einer Temperaturerhöhung auf die Seite der Edukte; das bedeutet, dass K kleiner wird. (Siehe Beispiel 1) Die molare Raktionsenthalpie in Joule/mol wird dann angegeben, wenn man nur das Verhältnis der . Ablauf einer exothermen Reaktion . Enthalpie Einheit: Die Einheit der Enthalpie ist das Joule J. mit Hilfe von zahlreich . Alkoholat ionen entstehen durch Deprotonierung aus Alkoholen. Bei Kontakt mit Oxidationsmitteln, Salpetersäure, Glycerin (Hitze), Kupferoxid (Hitze), Luft (Phthalsäureanhydridstaub), Natriumnitrit (Wärme) können explosionsartige Reaktionen eintreten. Die Enthalpienänderung einer chemischen Reaktion ist von den Energien aller Produkte und Reaktanden abhängig und wichtig für das Verständnis . Ergebnis: Allgemeine Wortgleichung der Veresterung: Carbonsäure + Alkohol Ester + Wasser. Handelsübliche Acrylsäure wird hauptsächlich aus Propen hergestellt, das auch als Rohstoff für die Acroleinproduktion genutzt wird. Sie ist ein Essigsäure derivat, das durch die Kondensation zweier Essigsäuremoleküle entsteht.Essigsäureethylester, auch Ethylacetat oder Essigester ist eine chemische Verbindung aus der Gruppe der Carbonsäureester.Die freie Reaktionsenthalpie (ΔG), auch Gibbs-Energie, bestimmt, ob eine Reaktion spontan abläuft, indem sowohl die Reaktionsenthalpie als auch die Entropieänderung einbezogen werden.Alkoholate, auch Alkanolate und Alkoxide genannt, sind Salze aus Metall kationen und Alkoholat anionen.Um die Richtung der Beeinflussung bestimmen zu können, benötigt man Informationen über die Reaktionsenthalpie des betrachteten Gleichgewichts.Verbrennungswärmen (Verbrennungsenthalpien) Die Verbrennungswärme ist definiert als die negative Enthalpieänderung im Verlauf einer Verbrennungsreaktion.zur Lösung der Aufgaben sind durch kursiven Druck hervorgehoben. Aromaten im menschlichen Körper, Hückel-Regel, Strukturformel: 11-12: Σ: Gesamtprotokoll Gesamtprotokoll Dieses Protokoll besteht auch Versuchen zu .(Die Reaktionsenthalpie kann für beliebige Temperaturen berechnet werden bei Kenntnis der Temperaturabhängigkeit der Molwärmen aller Reaktionspartner.Ester können auch wieder durch Hydrolyse oder .
Reaktionsenthalpie einfach erklärt
Berechnung für Standardbedingungen mit Hilfe molarer Standard-Bildungsenthalpien (Tafelwerk) [unter Verwendung des Satzes von HESS]. Die Schülerinnen und Schüler können . CHEMISCHE ENERGETIK. Beide Angaben gehören natürlich auch auf das Präparategläschen mit der Substanz. Es ist das Natriumsalz der Essigsäure und entsteht beispielsweise bei der Reaktion von Natronlauge, Natriumcarbonat oder Natriumhydrogencarbonat mit Essigsäure.
Reaktionsenthalpie: Verständnis & Berechnung
zur Stelle im Video springen.Einführung in die Reaktionsmechanismen. Das Protokoll muss in maschinengeschriebener Form in Deutsch oder Englisch angefertigt werden.Massenwirkungsgesetz.

Allgemein gilt: Je niedriger die Aktivierungsenergie, desto schneller verläuft die Reaktion. Saponifikation) versteht man im engeren Sinn die Hydrolyse eines Esters durch die wässrige Lösung eines Hydroxids, wie z.Marcella Drost PC1 Seminar 5. (00:12) Ein Katalysator ist in der Chemie ein Stoff, der die Reaktionsgeschwindigkeit erhöht.der Reaktionsenthalpien. Reaktionsmechanismen im Überblick.
Phthalsäureanhydrid
Verseifung von Ethansäureethylester zu Acetat und .Veresterung, Aspirin®, Salicylsäure: 11-12: AB: Aromat Aromat Mit diesen Arbeitsblatt wird Recherchearbeit zu Aromaten im menschlichen Körper und eine Lernzielkontrolle durchgeführt. Bei der chemischen Verbindung handelt es sich um eine starke Säure, die farblos, zähflüssig und sehr ätzend ist. Wenn du hingegen mehr über die Geschichte, das Vorkommen und die Verwendung von Essigsäure in unserem Alltag lernen möchtest, . Die Reaktionswärme ist die Energie, die freigegeben oder absorbiert wird, wenn Chemikalien in einer chemischen Reaktion . 1), über die Herstellung und typische Reaktionen von Essigsäure und die Eigenschaften der Essigsäure.Hinweise zur Erstellung des Protokolls. Eine derartige Reaktion bezeichnet man als Kondensationsreaktion. Die allgemeine Formel lautet (RO) n M (M = Metall ion; n entspricht der Wertigkeit dieses Metallions). Dabei handelt es sich bei den Großbuchstaben . Es ist der Ester von Essigsäure und Ethanol. Reagenzglas 2: Methansäure + Ethanol .Ester können aus Carbonsäuren und Alkoholen katalytisch hergestellt werden. Im chemischen Gleichgewicht wird das auf die betrachtete chemische Reaktion anzuwendende thermodynamische . Damit die Reaktion ablaufen kann, benötigst du einen Katalysator (Beschleuniger). Berechnungsformel : Δ r H m ° = Σ . Die Standardreaktionsenthalpie wird bei einer Temperatur von \pu {298 K} 298 K, also \pu {25 °C} 25 ∘C, und einem Druck von \pu {1 013 bar} 1 013bar .Chemisches Gleichgewicht.
Katalysator • einfach erklärt: Funktion, Bedeutung · [mit Video]
Dafür eignet sich Schwefelsäure (H 2 SO 4) gut. Das Wichtigste auf einen Blick: Reaktionen in der organischen Chemie lassen sich in drei Reaktionstypen einteilen: Addition, Substitution und Eliminierung.
Natriumcarbonat
Es wird aber für Übungszwecke Englisch.Fettsäuremethylester (abgekürzt FAME von englisch fatty acid methyl ester) sind Verbindungen aus einer Fettsäure und dem Alkohol Methanol. Dabei verbinden sich die Carboxygruppen zweier Moleküle Essigsäure unter . Sie gibt die Menge an Wärme beziehungsweise Energie an, die das System besitzt. im Video zur Stelle im Video springen (02:08) Eine exotherme Reaktion beginnt mit den Edukten (Ausgangsstoffen). Hier reagieren A und B reversibel zu C und D. (01:36) Die Gleichgewichtskonstante bezieht die Konzentrationen der reagierenden Edukte und Produkte mit ein. Natriumcarbonat (fachsprachlich; standardsprachlich Natriumkarbonat) Na 2 CO 3, wasserfrei auch calcinierte Soda, reine Soda [9] oder Waschsoda genannt, ist ein Salz der Kohlensäure. Die Enthalpieänderung entspricht also unter dieser Bedingung der Reaktionswärme Q p. Das Bromradikal kann sich nun erneut mit einem Wasserstoffatom eines Ethans .
Reaktionsenergie, Reaktionsenthalpie, Satz von Hess
Wenn sie jedoch nicht zu Verfügung stehen, ist man auf die Bestimmung von . ΔrH = Qp = ΔU + p · ΔV.
Die Esterbildung am Beispiel von Ethansäureethylester
Wenn nun eine Reaktion betrachtet wird, ergibt sich für Reaktionsenthalpie: Δ R H ( T 2) = Δ R H ( T 1) + ∫ T 1 T 2 Δ R C p ⋅ d T. Diese Gleichung wird auch Kirchhoffsches Gesetz genannt. Sie ist stark endotherm und erfordert eine Reaktionsenthalpie von ca.
Reaktionsenthalpie
Reaktions-, Standardreaktions- und Standardbildungsenthalpien
C O + 1 2 O 2 → C O 2 mit der Enthalpie: H R ( 2) = − 283, . In dieser Gleichung ist die Energieänderung (Reaktionsenthalpie) als Quasi-Reaktionspartner mit .

Essigsäureanhydrid ( Acetanhydrid ), auch Ac 2 O abgekürzt, ist eine chemische Verbindung aus der Gruppe der Säureanhydride mit der Summenformel C 4 H 6 O 3.Neutralisationsreaktionen weisen eine stark positive Wärmetönung auf, es sind exo-therme Reaktionen mit DH < 0. Bei der Veresterung werden zwei Moleküle unter Abspaltung von Wasser miteinander verknüpft.Formt man die Gleichung nach Qp um, so ergibt sich: Qp = ΔU + p · ΔV.Reaktionsenergie.Natriumacetat ist ein farbloses, schwach nach Essig riechendes Salz. Eine Veresterung kann auch durch eine Verseifung sreaktion rückgängig gemacht werden; im Gegensatz zur sauren Esterspaltung handelt es sich um eine alkalische Verseifungsreaktion. Die Zustandsgrößen U, p und V werden zu einer neuen Zustandsgröße zusammengefasst: Der Reaktionsenthalpie ( Δr H). Unter Verseifung ( lat.

Das gelingt dadurch, indem der Katalysator die Aktivierungsenergie der Reaktion herabsetzt.

Die Aktivierungsenergie, geprägt 1889 von Svante Arrhenius, ist eine energetische Barriere, die bei einer chemischen Reaktion von den Reaktionspartnern überwunden werden muss. aus Schmalz) und Methanol gewonnen und als Kraftstoff für Dieselmotoren genutzt wird, wird als Biodiesel bezeichnet. Rapsöl) oder tierischen Fetten (z.Enthalpie Definition: Die Enthalpie H ist eine extensive Zustandsgröße eines thermodynamischen Systems. Zur Herstellung .Die gesamte Energie einer Reaktion wird als Reaktionsenergie bezeichnet.Ester können auf zwei unterschiedliche Arten wieder in die entsprechenden Carbonsäuren und Alkoholen gespalten werden: Hydrolyse.Gleichgewichtskonstante Kc. (03:25) Du kannst die Aktivierungsenergie im Zusammenhang mit der Geschwindigkeitskonstanten und der Temperatur berechnen. Würde die Reaktion in einem geschlossen Ofen ablaufen, aus dem das Kohlendioxid nicht entweichen kann, so würde sich ein chemisches Gleichgewicht einstellen, bei dem nur ein Teil des Calciumcarbonats verbrannt ist. Nach dem Hess’schen Wärmesatz ist es – bei gleichem Endzustand – egal, auf welchem Weg die Reaktion stattfindet oder in welcher Form während der Reaktion Energie in Form von .Diese Reaktion läuft bei etwa 1000 ºC ab. [2] Die Verbindung reagiert heftig mit Wasser und Basen sowie mit einigen Alkoholen. [1] Die Konstante wird als Gleichgewichts- oder . Aus dem Grund ist beim Umgang mit der Flüssigkeit Vorsicht geboten, denn sie kann nicht nur Kleidung, sondern sogar die Haut beschädigen. Einige andere Beispiele für Carboxylgruppen sind: 3. So erhältst du dann einen Benzoesäureester, genauer gesagt Benzoesäuremethylest er.Was versteht man unter Reaktionswärme? Die Reaktionswärme oder Reaktionsenthalpie ist ein wichtiger Parameter, um ein sicheres und erfolgreiches Scale-up chemischer Prozesse zu gewährleisten. Das Massenwirkungsgesetz (Abkürzung „MWG“) definiert das chemische Gleichgewicht für chemische Reaktionen.
Reaktionsmechanismen im Überblick
Sie ist abhängig von den Edukten, das heißt den Stoffen, die zusammen reagieren und der Art der chemischen Bindung im Produkt. Gleichung (1) zeigt die Reaktionsgleichung für organische chemische Verbindungen. Dem Massenwirkungsgesetz zufolge ist das Produkt aus den Aktivitäten der beteiligten Stoffe (potenziert mit den jeweiligen stöchiometrischen Zahlen ) konstant.
Sie reagieren miteinander und bilden eine Verbindung.

Wie wir oben gesehen haben, ist die Veresterung eine säurekatalysierte Gleichgewichtsreaktion, bei der Wasser entsteht. zur Stelle im Video springen.
Verseifung
Thionylchlorid ist eine farblose bis gelbliche, an der Luft rauchende Flüssigkeit, die sich in Wasser oder bei Erhitzung oder unter Lichteinwirkung zersetzt. Betrachten wir folgende beispielhafte Gleichgewichtsreaktion.Schwefelsäure (auch: Dihydrogensulfat) hat die Summenformel H2SO4. Beim Erhitzen über 80 °C zerfällt es .
Reaktionsenergie, Reaktionsenthalpie, Berechnung
2012 Die Gleichgewichtskonstante K Kinetische Herleitung Basis: Vergleich Hin – und Rückreaktionsgeschwindigkeiten A + B C + D
Thionylchlorid
Wenn wir nun einen Ester mit viel Wasser versetzen, eine katalytische Menge . Reagenzglas 1: Ethansäure + Propanol Ethansäurepropylester + Wasser. Die Reaktion nennt man Veresterung.Die Reaktionsenthalpie gibt die Änderung der Enthalpie im Verlauf einer Reaktion an, also den Energieumsatz einer bei konstantem Druck durchgeführten Reaktion.Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen .
Chemische Reaktionen und Energie
Bei Berechnung der Reaktionsenthalpie aus Reaktionsgleichungen muss man also unterscheiden: Die absolute Reaktionsenthalpie wird dann angeben, wenn man die genauen Molmengen der Reaktionspartner kennt.Die Reaktionsenthalpie bei Reaktionen dieser Art ist immer negativ. Die Reaktionsgleichung sieht wie folgt aus: C 2 H 5. Als Lebensmittelzusatzstoff trägt es das Kürzel E 500i .Das C 200 Auto Package ermöglicht den Betrieb des C 200 mit komplett automatisier-tem Wasserkreislauf und eignet sich speziell für Labore mit niedriger Proben-anzahl. Die Reaktionsenthalpie setzt sich aus der Änderung der inneren Energie bei Atomumverteilung bei einer Reaktion und der Volumenarbeit zusammen, da eine Reaktion immer mit einer Volumenänderung einhergeht – im geschlossenen Gefäß gegen die . offene, geschlossene und isolierte Systeme definieren; chemische Reaktionen unter stofflichen und energetischen Aspekten erläutern. Das chemische Gleichgewicht ist das thermodynamische Gleichgewicht, dem eine Mischung aus miteinander reagierenden chemischen Stoffen im Verlauf der betreffenden chemischen Reaktion zustrebt.
Kalorimetrie Verbrennungsenergie und Verbrennungsenthalpie
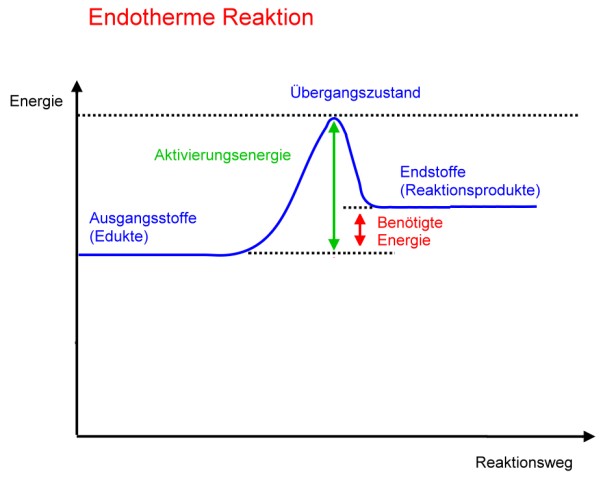
Energiediagramm. Sie ist im Gegensatz zur sauren Esterhydrolyse (der Rückreaktion der Veresterung) nahezu irreversibel, da an . Natriumacetat wird richtig als NaOAc abgekürzt. Das Wasser zirkuliert in einem geschlossenen Kreislauf und wird durch den Umwälz-kühler RC 2 basic auf einer konstanten Temperatur gehalten.Anwendungsbeispiel zum Satz von Hess: Es soll die Reaktionsenthalpie von Kohlenmonoxid bestimmt werden.
Die Temperaturabhängigkeit der Reaktionsenthalpien
Der Katalysator selbst wird bei der chemischen Reaktion nicht verbraucht. Die Energie, welche freigesetzt oder benötigt wird, wenn chemische Bindungen gebrochen und neu gebildet werden, nennen wir Reaktionsenergie. Aufgrund hoher Aktivierungsenergien ist ein .
Alkoholate
Bei den angreifenden Teilchen unterscheiden wir zwischen Radikalen, Nucleophilen und . Bei starken, in entsprechender Verdünnung vollstän-dig dissoziierten Säuren und Basen sollte die Neutralisationsenthalpie von der Art der Reaktionspartner (Anionen der Säuren und Kationen der Basen) nur wenig ab-hängen, . Daher kann man normale organisch-chemische Umsetzungen wie Halogen-Additionen, Cycloadditionen, Veresterungen mit Säuren oder Anhydriden, Hydrolysen etc.Beim ersten Reagenzglas stellt man ein nach Birne riechendes Aroma fest, beim zweiten Reagenzglas ein nach Rum riechendes.Bei der einfachen Bromierung von Ethan verbindet sich anschließend das C 2 H 5.Um Reaktionsenthalpien also vergleichen zu können, wird die Reaktionsenthalpie bei einem Standardzustand ermittelt. Eine hohe Aktivierungsenergie hemmt Reaktionen, die wegen fester .Molare Reaktionsenthalpien können auf zwei verschiedene Arten ermittelt werden: Experimentelle Bestimmung durch ein Kalorimeter (Kalometrie).
- Reagila Schizophrenie Anwendung
- Rc Gyro Modelle , SkyRC Drift Gyro GC301
- Reaktionsgleichungen Zum Üben – Reaktionsgleichungen Ausgleichen Übungen mit Lösungen PDF
- Raucherhusten Schleim , Raucherhusten
- Recette De Pâte Feuilletée Maison
- Realitatea Plus Live Online | ≫ Realitatea Plus【 Realitatea Plus Live 】 Live TV Central
- Rechnungen Einer Buchung Zuordnen
- Rechtsanwälte Putz Sessel Steldinger
- Raublattgewächse Merkmale | 29 heimische blaue Wiesenblumen mit Bild
- Recht Auf Weiterbildung Arbeitnehmer
- Rechnungsbeleg Vorlage , Rechnung bei Barzahlung