Phasenübergänge In Der Chemie – Latentwärmespeicher
Di: Samuel
Im Phasendiagramm wird der Tripelpunkt dargestellt als der Punkt, an dem die Linien für Feststoffe, Flüssigkeiten und Gase zusammenkommen.) oder ein Stoffgemisch ( Mischphase, Mischung) mit konstanten oder nur stetig veränderlichen makroskopischen Eigenschaften, wie Dichte, Konzentration, Brechungsindex, Extinktionskoeffizient oder spezifische Wärme. Ferroelektrizität beschreibt das Phänomen, dass Stoffe mit einem elektrischen Dipolmoment durch das Anlegen eines äußeren elektrischen Feldes die Richtung der spontanen Polarisation ändern. Strukturänderung durch Phasenübergänge.Ein Phasenübergang ist der Wechsel eines Stoffes von einem Aggregatzustand in einen anderen, etwa Schmelzen, Kondensieren oder Sieden.Phasenübergang. Während des Phasenüberganges wird dem Stoff Wärme . Bei endothermen Reaktionen wird Energie aufgewendet.
Als Resublimieren werden verschiedene Vorgänge bezeichnet: eine Methode der Stoffreinigung und der Stofftrennung, bei der ein Sublimationsvorgang mehrfach nacheinander durchgeführt wird. Während man bereits seit längerer Zeit weiß, dass katalytische Reaktionen durch Phasenübergänge initiiert .Lexikon der ChemiePhase. Daher ist Hartparaffin mit einer . Ausgehend von einzelnen, ultrakalten Atomen ist es Physikern der Universität Heidelberg in Experimenten gelungen, bei zunehmender Teilchenzahl die Entstehung . Das liegt daran, dass eine Änderung des Druckes in .Phasenübergänge werden dann in sogenannte Ordnungen eingeteilt, wobei die n-te Ordnung der Funktion der betrachteten Größe gegen die Temperatur eine Unstetigkeit in der n-ten Ableitung aufweist. Der Verlauf der Phasenumwandlung erfolgt über einen instabilen Punkt.
Chemie & Schule
Phasenübergänge erster und zweiter Ordnung
Auch zum Thema Phasendiagramm des Wassers haben wir einige interaktive Übungen vorbereitet.Herleitung der Clausius-Clapeyron-Gleichung. 2: Ein Beispiel für einen Phasenübergang zweiter Ordnung: Die tetragonale Phase dehnt sich in zwei Raumrichtungen bevorzugt aus und .
Eine graphische Darstellung der Stabilitätsbereiche der Phasen in Abhängigkeit von den Zustandsvariablen wie Druck, Temperatur, chemischer Zusammensetzung und magnetischer Feldstärke liefern . PHASENGLEICHGEWICHTE 3 diedreiZustandsgr oˇennichtunabh angigvoneinandergew ahltwer- den k onnen, sondern nP . Verschiedene P.Der zweite Hauptsatz der Thermodynamik Phasenübergänge Chemische Umwandlungen Chemische Kinetik Quantentheorie Struktur der Atome Die Chemische Bindung Molekulare Wechselwirkungen Molekülspektroskopie Statistische Thermodynamik Magnetresonanz Makromoleküle Festkörper In meinen Augen das beste Werk zur . (00:34) Das wohl bekannteste aller Phasendiagramme ist das des Wassers.Ausgabe 3/22 – Die Phasenübergänge des Wassers – Eine sprachsensible Lernaufgabe für die Sekundarstufe I.Das Phasendiagramm ist ein Hilfsmittel in der Chemie, Physik und speziell den Materialwissenschaften für die Veranschaulichung von Zuständen und deren zugehörigen Phasen.Das chemische Potential μ charakterisiert die Möglichkeiten eines Stoffes, . Der Wert wurde im Satellit bestimmt, um Druckunterschiede in der Flüssigkeit zu minimieren. Bei exothermen Reaktionen wird Energie freigesetzt. Die DTA nutzt die Tatsache eines charakteristischen Energieumsatzes beim Phasenübergang zur qualitativen und quantitativen Analyse.Um zu einem Phasenübergang zu gelangen, muss man also die chemischen Potentiale der einzelnen Phasen relativ zueinander verschieben, was man am einfachsten durch Änderung der Temperatur erreicht. Während dieser Übergang, der Dampf Der Druck der Substanz nimmt mit zu steigende Temperatur. Der chemische Grundbaustein ist das Atom. Hier finden Sie das .

Insbesondere nennt man einen Phasenübergang, für den die erste Ableitung des chemischen Potentials nach der Temperatur dieses Merkmal aufweist, einen Phasenübergang erster Ordnung . Führt man in einem isolierten System einem Gegenstand eine Wärmemenge zu, so erhöht sich dessen Temperatur . Kostenlos testen Atomaufbau. Für einen Feststoff ändert sich die Regel ein wenig, indem die 2 durch eine 1 ersetzt wird: F = K – P + 1.
Sublimieren ist ein grundlegender Begriff in der Chemie und bezieht sich auf den Prozess, bei dem eine Substanz direkt vom festen in den gasförmigen Zustand übergeht, ohne durch den flüssigen Zustand zu gehen.Phasenübergänge und Phasendiagramme sind zentrale Konzepte in der Chemie und Physik, die helfen, das Verhalten von Materialien unter verschiedenen Bedingungen zu verstehen. Salz in Wasser . Molvolumen V [ L ] = 22,414 L/ mol; univ. an der Phasengrenze als Grenzfläche eindeutig beschreiben.Eine Reaktion, Umwandlung oder Umverteilung kann freiwillig nur stattfinden, wenn das chemische Potential im . Sie gehört zur Gruppe der Methoden der thermischen Analyse. Phasenübergänge lassen sich nach Ehrenfest in ihrem Verhalten hinsichtlich der .Polymere können durch chemische Modifikationen oder Einbettung von Partikeln auf verschiedenste Umgebungsbedingungen mit Veränderungen ihrer Eigenschaften oder mit Phasenübergängen reagieren.
Phasendiagramm
Sublimation (Phasenübergang) Sublimationsapparatur mit einem Kühlfinger, an dem der sublimierte Stoff sich abscheidet. sublimis = ‚hoch in der Luft befindlich . eine Phasentransformation ist in der Thermodynamik die Umwandlung einer oder mehrerer Phasen in andere Phasen. Das heißt, die Enthalpie des Stoffes verändert sich, ohne dass die Temperatur ansteigt, oder sich der Druck bzw.de bieten Ihnen eine Newsübersicht aktueller Wissenschafts- und Branchennachrichten für Phasenübergänge von ETH Zürich für die Branche ChemieKeimbildung oder Nukleation ist der erste Teilprozess, der einen Phasenübergang erster Ordnung einleitet. Bei chemischen Reaktionen wird immer Energie umgesetzt.Anwendung finden Phasendiagramme .Drucks und/oder der Temperatur Klassifizierung Phasenübergänge 1. Ein weiterer markanter Punkt in dem Diagramm liegt bei 374 °C und einem Druck von 221 bar. Neben den drei Phasen fest, flüssig und gasförmig, existieren auch drei Kurven, die die Phasenübergänge markieren: die Sublimations-, die Schmelz- und die Dampfdruckkurve. Das bedeutet, dass.
Tripelpunkt: Wasser & Phasenübergänge
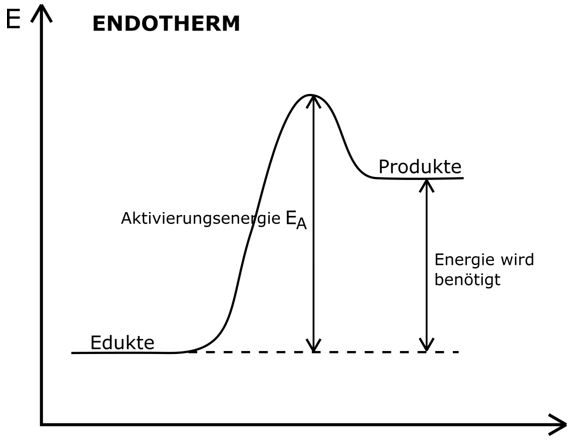
Die Aktivierungsenergie muss aufgewendet werden, um eine chemische Reaktion zu starten. Art Phasenübergänge 2. Die Van-der-Waals-Kräfte halten sie aber noch in ihrer . Die Clausius-Clapeyron-Beziehung ermöglicht uns eine Quantifizierung diese Beziehung. mit anderen Stoffen zu reagieren (chemische Reaktion);in eine andere Zustandsform überzugehen (Phasenübergang);sich im Raum umzuverteilen ().Phasengrenzlinie. Phase, ein chemisch einheitlicher Stoff ( reine P .
Phasendiagramm: Kritischer Punkt & Beschriftung
Sie setzt sich daher aus Punkten (Zuständen) des jeweiligen Phasendiagramms (Stoffes) . Im Phasendiagramm stellt der Punkt das obere Ende der Dampfdruckkurve dar. Beispiele hierzu sind das Schmelzen von Eis oder das Verdampfen und Kondensieren von Wasser. wird in der Technik auch heute noch vielfach als Normkubikmeter (Kurzz.Sublimation (Phasenübergang) (Weitergeleitet von Sublimation) Dunkelgrüne Kristalle von Nickelocen, frisch resublimiert an einem aus der Sublimationsapparatur herausgenommenen Kühlfinger. Phasenübergang, Phasenumwandlung, Übergang von einer thermodynamischen Phase in eine andere bei einem charakteristischen Wert von Druck und Temperatur.
Die gefundenen Phasenübergänge, also die physikalische oder chemische Veränderung von Stoffen und ihren Eigenschaften, sind von wesentlicher Bedeutung bei Katalysatoren in Gas- und Flüssigphasenreaktionen.de bieten Ihnen eine Newsübersicht aktueller Wissenschafts- und Branchennachrichten für Phasenübergänge aus Deutschland für die Branche Chemie
Latentwärmespeicher
In diesem Artikel ist der Phasenübergang beschrieben, der auch als Resublimation, Desublimation, Solidifikation oder Deposition bezeichnet wird.Eine Voraussetzung dafür ist allerdings, dass sich der Aggregatzustand des Gegenstands während der Wärmezufuhr .In der Thermodynamik ist der kritische Punkt ein thermodynamischer Zustand eines Stoffes, der sich durch Angleichen der Dichten von flüssiger – und Gasphase kennzeichnet.de bieten Ihnen eine Newsübersicht aktueller Wissenschafts- und Branchennachrichten für Phasenübergänge für die Branche Chemie

Ein Phasenübergang bzw. Enthalpieabgabe, weil die zugeführte Energie für chemische Prozesse auf Teilchenebene verwendet wird.Schmelzwärme → Phasenübergang fest↔flüssig Kristallisationswärme → Phasenübergang zwischen amorpher und kristalliner Struktur Die spezifische latente Wärme für einen jeweiligen Phasenübergang ist tabelliert – für die Elemente, siehe Periodensystem der Elemente. Zeitabschnitte verwendet . sind gegeneinander . Wir können uns auch qualitativ klarmachen, was geschieht, wenn wir etwas zu unserer reinen Substanz zugeben, z.
Wärmekapazität und Phasenübergänge — Grundwissen Physik
Das Messergebnis stimmt genau mit theoretischer Voraussage überein, die mit Hilfe der . Diese Gleichung präsentiert das chemische Potential μ als die Änderung der inneren Energie U aufgrund der Änderung der Anzahl der Mole N, bei gleichbleibendem Volumen V und Temperatur T. Wasser ist mit einer Schmelztemperatur von 0 °C ungeeignet, weil diese nicht im Arbeitsbereich liegt. Eine grafische Darstellung der Stabilitätsbereiche der Phasen in Abhängigkeit von den Zustandsvariablen wie Druck, Temperatur und chemischer Zusammensetzung .
Phasengrenzen
Aggregatzustände und Phasenübergänge; Chemische Reaktionen; Quantitative Analyse (chemisches Rechnen) Quellen; Kostenloser Download Lernleitfaden Medizin Mit Video-Repetitorien von Lecturio kommst du sicher durch Physikum, M2 und M3.
Was ist ein Phasenübergang?
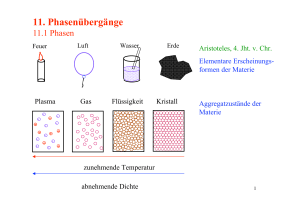
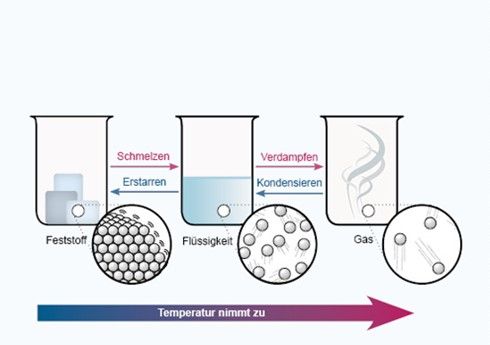
Wärmekapazität und Phasenübergänge¶. eine Phasenumwandlung oder Phasentransformation ist in der Thermodynamik die Umwandlung einer oder mehrerer Phasen eines Stoffes in andere Phasen. Als Sublimation, seltener auch Sublimierung (von lat. Das Wichtigste auf einen Blick.Ferroelektrikum. Bei Wasser beispielsweise sind die drei Kurven, die die Zustände fest, flüssig und gasförmig repräsentieren, alle im Tripelpunkt verbunden.Der am genauesten gemessene Wert von α ist -0,0127 für den Phasenübergang des supraflüssigen Heliums (der sogenannte lambda-Übergang). Die Funktion selbst und die n-1-te Ableitung sind stetig. Aggregatzustände und Phasenübergänge von Wasser. Oftmals wird die Siedekurve danach nicht mehr angezeigt, da es nicht mehr möglich ist, eine klare Trennung zu erreichen. Flüssigkeit / Gas. Beispiele hierfür sind das Gefrieren von Wasser zu Eis, Blasenbildung beim Übergang von der flüssigen zur gasförmigen Phase (z.der Wärmemenge, die bei Phasenübergängen im nutzbaren Temperaturbereich frei wird.
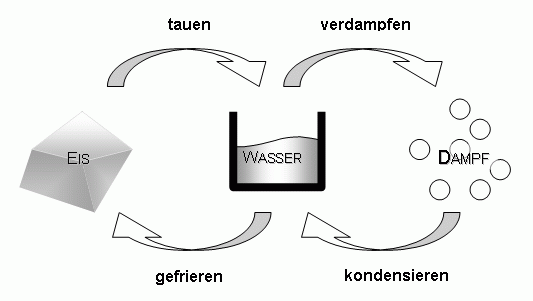
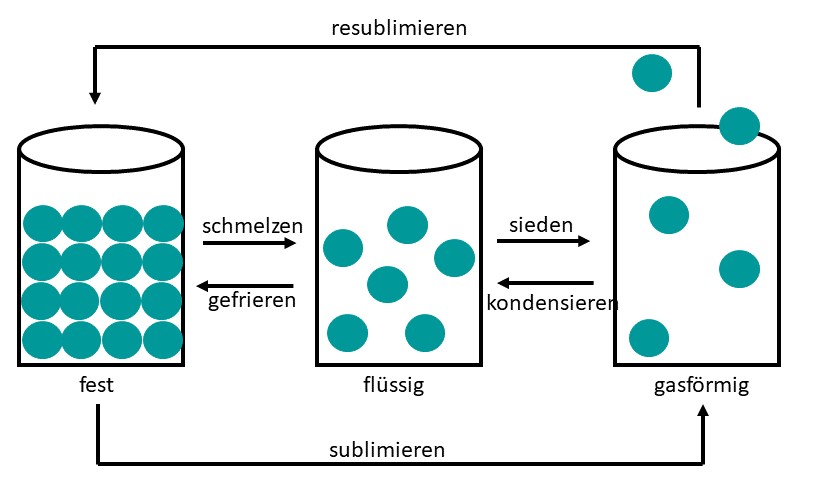
Aggregatzustand
Unter einer Phasengrenzlinie versteht man die Gesamtheit der Zustandsgrößen, welche den Zustand eines Stoffes oder Stoffgemisches während eines Phasenübergangs bzw.Die Differenz-Thermoanalyse ( DTA) ist ein thermisches Verfahren zur Materialanalyse. Sie bieten Einblicke in die Zustände, die eine Substanz einnehmen kann, sowie die Bedingungen, unter denen diese Zustandsänderungen stattfinden.Phasenübergänge; Stofftrennung fest flüssig gasförmig schmelzen verdampfen erstarren kondensieren sublimieren resublimieren Liegt Materie in einem physikalischen System ohne makroskopische Trennflächen vor, spricht man von einer Phase. In der Praxis unterscheidet man nur zwischen Phasenübergängen 1. Feststoff / Flüssigkeit. sublimare, früher im Sinne von „läutern, destillieren, chemisch möglichst rein darstellen“, [1] von sublimis „hoch in der Luft befindlich .Wie zuvor erwähnt, wird das chemische Potential mathematisch durch die Formel μ = ( ∂ U ∂ N) V.Für Gase und Flüssigkeiten lautet die Gibbssche Phasenregel: F = K – P + 2. In der Ausgabe 3/22 von Chemie & Schule ist der Artikel Die Phasenübergänge des Wassers – Eine sprachsensible Lernaufgabe für die Sekundarstufe I von Julia Dörrer, Rita Krebs und Anja Lembens erschienen. In der modernen Physik werden auch noch anderen Zustandsänderungen als Phasenübergang bezeichnet, etwa wenn Eisen bei Erwärmung über die Curie-Temperatur nicht mehr ferromagnetisch ist, oder . Daher ist man auf Stoffe mit Schmelztemperaturen zwischen 40 °C und 70 °C und mit hoher Schmelzwärme angewiesen. Das geschieht, wenn die Partikel von Festkörpern genügend Energie gewinnen, um in die Gasphase ohne flüssige Phase zu wechseln.
Anorganische Chemie › Zustandsformen der Materie
Gaskonstante R = 8,3143 bar x L / K x mol; Phasenübergänge.Phasenübergänge beschreiben dramatische Veränderungen der Eigenschaften eines makroskopischen Systems – zum Beispiel den Wechsel von flüssig zu gasförmig.das chemische Potenzial vom Druck und von der Temperatur ab: (p;T).
Zwei, sechs, viele
beim Öffnen einer Wasserflasche mit gelöstem Kohlendioxid) oder die Kondensation eines Gases.: Nm3) bezeichnet.
Zustandsänderung
Responsivität findet man für Umgebungsparameter wie pH-Wert, Salzkonzentration, Lichtintensität, magnetische . Durch Erhöhen der Temperatur (Zufuhr von thermischer Energie) bewegen sich die kleinsten Teilchen immer heftiger, und ihr Abstand voneinander wird (normalerweise) immer größer. Wärme kann als eine Energieform aufgefasst werden.Hier sind zum einen die Änderungen von Aggregatzuständen und die damit einhergehenden Phasenübergänge von Stoffen zu erwähnen, die stets auch mit einer Entropieänderung verbunden sind. Zusammenhang von Zustandsgrößen und Freiheitsgraden nach der Gibbsschen Phasenregel.
Differenz-Thermoanalyse
Die Ferroelektrizität wurde früher als Seignette-Elektrizität bezeichnet, da sie am Seignettesalz ( Kaliumnatriumtartrat) .: phasis = Erscheinung abgeleiteter Begriff, der im allg. Solch eine Beziehung gilt fur jede der nP Phasen (nur nat urlich in jeweils anderer funktionaler Form). An diesem Punkt liegen flüssiger und gasförmiger Aggregatzustand im Gleichgewicht vor.
Enthalpie an Phasenübergängen einfach erklärt
Latente
Die Messung basiert auf einem Vergleich der Temperaturen der . zur Stelle im Video springen. Die Aggregatzustände sind Phasen; die Änderung des Aggregatzustands ein Phasenübergang. Beispiele: Ferroelektrizität Ferromagnetismus Supraleitung Superfluidität Ordnung-Unordnung (AB) Umwandlungen am kritischen Punkt Kristallisation Kondensation Sublimation .Nichtgleichgewichts-Phasenübergänge und Selbstorganisation in Physik, Chemie und Biologie 247,85 € Nur noch 1 auf Lager Previous page Seitenzahl der Print-Ausgabe Frisch resublimiertes Ferrocen an einem Kühlfinger. Ein Unterschied zwischen beiden Aggregatzuständen hört an diesem Punkt auf zu existieren.Um die Clausius-Clapeyron-Beziehung zu verstehen, betrachten wir einen Stoff, der einen Phasenübergang von einer Flüssigkeit zu einem Gas durchläuft.Am Phasenübergang kommt es zu einer Enthalpiezunahme bzw.Der kritische Punkt im Phasendiagramm. Alternative Bezeichnungen sind unter anderem Zustandsdiagramm, Zustandsschaubild oder Gleichgewichtsschaubild. Als Sublimation, seltener auch Sublimierung (von lateinisch sublimatio bzw.Die Besonderheit des Phasendiagramms des Wasser wird dann im Einzelnen an verschiedenen Beispielen verdeutlicht, wie dem Schlittschuhlaufen, der Gletscherschmelze und dem Verflüssigen von Seewasser unter einer Eisdecke. Sinne für Entwicklungs- u.
Phasenübergang
Energieumsatz bei chemischen Reaktionen. das Volumen ändert.Teilchenmodell der Phasenübergänge.de bieten Ihnen eine Newsübersicht aktueller Wissenschafts- und Branchennachrichten für Phasenübergänge
- Philips Bügeleisen Mit Abschaltautomatik
- Pharaoh A New Era Spiele _ Ein großer Aufbau-Klassiker kehrt endlich zurück!
- Pflegeschule Brakel : Altenheim Lemgo
- Pflücksalat Ernten Wie Lange , Pflücksalat » Die Sorten im Überblick
- Physik Resultierende Kraft _ Gleichgewicht von Kräften (Einführung)
- Ph Wert Im Pool Berechnen , Pool-Volumen berechnen online: So viele m³ hat dein Pool
- Phantom Ranch Hiking – Hiking Frequently Asked Questions
- Physikalische Größe Neutronen _ Atomaufbau: Elemente, Elektronen & Historie
- Php Leer Prüfen : if-Anweisungen
- Phönix Cel 70 : Bohler Stick Electrode
- Pflastersteine Ausbessern | So kannst du Pflastersteine reparieren die wackeln oder sich lösesn