Kritischer Punkt Dampf – Druck-Enthalpie-Diagramm
Di: Samuel
Anwendungen und Bedeutung.Die Vorgabe von p legt für ein Flüssig-Dampf-System die Temperatur (Siedetemperatur. Temperatur Druck Dichte Siedepunkt bei 1,013 bar. In der Thermodynamik ist ein Tripelpunkt (auch Dreiphasenpunkt) ein Zustand eines aus einer einzigen Stoffkomponente bestehenden Systems, in dem Temperatur und Druck dreier Phasen im .Da die Temperatur von nassem Dampf nach 3.
Was ist überkritische Dampf
(Flüssig-Dampf . • Druck p • spezifi sche Enthalpie h • Temperatur T • spezifi sches Volumen v • spezifi sche Entropie s • Gasanteil x K Flüssigkeit Nassdampf überhitzter Dampf Siedelinie . nehmen und gemeinsam in einem p ( V ) -Diagramm darzustellen. bei differenzierbaren Funktionen ein Punkt, an dem das Differential der Funktion nicht surjektiv ist, siehe .Daher entspricht der kritische Punkt für Erdgas nur annäherungsweise dem des Methans. Kritischer Punkt von CO2: Liegt bei einer Temperatur von 31,1 °C und einem Druck von 7,39 MPa.Beim kritischen Punkt K hat der Dampf aufgrund des hohen Druckes schließlich die Dichte der Flüssigkeit erreicht, so dass die Dichten der Flüssigkeit und des Dampfes gleich sind. Im Falle des direkten Überganges vom gasförmigen zum festen Zustand, also bei einer Resublimation, nennt man diesen Punkt Frostpunkt. Überschlägig (ideal gerechnet, also unter Annahme von idealem Verhalten des Gases) enthält eine Gasflasche (bei Umgebungstemperatur) . Bei den kritischen und überkritischen Drücken wird eine Flüssigkeit als einphasige Substanz betrachtet, obwohl alle thermophysikalischen Eigenschaften innerhalb der kritischen . Nehmen Sie die Isothermen eines Stoffes für acht vorgegebene Temperaturen auf.
Unterschied zwischen Gas und Dampf
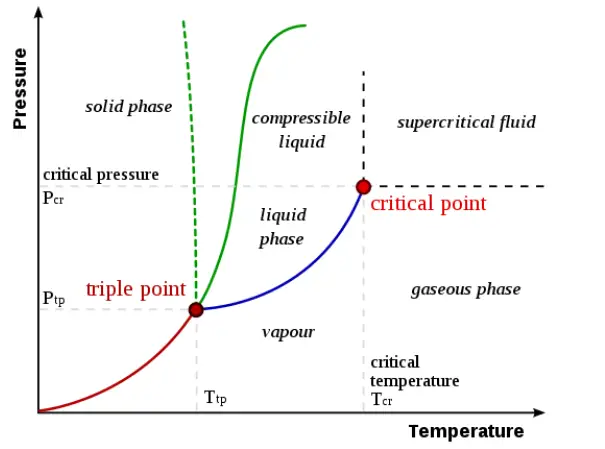
Kritischer Punkt (Thermodynamik) Phasendiagramm der festen (s), flüssigen (l), gasförmigen (g) und überkritischen (sc) Phase von Kohlenstoffdioxid mit kritischem Punkt P c und Tripelpunkt P t (nicht maßstabsgerecht) In der Thermodynamik ist der kritische Punkt ein thermodynamischer Zustand eines Stoffes, der sich durch Angleichen der .
Dampf
Verdichtet man ausgehend vom Zustandspunkt A 0 einen Dampf, dessen Zusammensetzung nach Abb. Isochoren 5 sind .
Kritischer Punkt
Punkt, in denen eine Funktion ein „kritisches Verhalten“ im folgenden Sinne zeigt: Kritische Punkte einer in einer offenen Menge D ⊂ ℂ meromorphen Funktion f sind die Punkte z0 ∈ D mit f ′ ( z0) = 0 und die mehrfachen Polstellen von f in D, d. zusätzlich zu den Standardbereichen Dampf, Flüssig-Dampf und Flüssigkeit, die im Mollier-Diagramm jedes herkömmlichen Kältemittels zu sehen sind, müssen auch der Bereich . In der Thermodynamik definiert der Begriff Sättigung einen Zustand, in dem ein Gemisch aus Dampf und Flüssigkeit bei einer bestimmten Temperatur und einem bestimmten Druck zusammen existieren kann. Unterhalb einer kritischen Temperatur $ T_{c} $ (rot markierte Isotherme im Bild) treten jedoch ein Maximum und ein Minimum auf (Punkte C und A), so dass bei einer isothermen . Wird in diesem Bereich das flüssige Wasser vollständig verdampft und dann die Temperatur weiter erhöht, so entsteht „überhitzter Dampf“.8 Thermische Zustandsgleichungen realer Gase 2. Die Unterschiede zwischen beiden Aggregatzuständen hören an diesem Punkt auf zu . (siehe auch p-T -Diagramm) p v.In der Thermodynamik ist ein kritischer Punkt (oder kritischer Zustand ) der Endpunkt einer Phasengleichgewichtskurve .Unterhalb des kritischen Punktes ist der Wasserdampf folglich „unterkritisch“ und kann sich im Gleichgewicht mit flüssigem Wasser befinden. Beschreiben Sie die Vorgänge, die in der Nähe des kritischen Punktes zu beobachten sind.
Dampfdruck
Dampf bezeichnet in Naturwissenschaft und Technik einen chemisch reinen, gasförmigen Stoff, .Durch den kritischen Punkt verläuft die kritische Isotherme. Die Verdampfungswärme ist die Wärme, die erforderlich ist, um eine Einheit gesättigter Flüssigkeit vollständig zu verdampfen (oder eine Einheit Masse gesättigten Dampfs zu .Am kritischen Punkt ist die Oberflächenspannung Null und der Dampfdruck gleich dem kritischen Druck.

Kritischer Punkt (Thermodynamik)
Dampf ist zum Beispiel Wasserdampf mit hoher Temperatur, während er bei Raumtemperatur eine . Critical-Point-Drying (CPD)) Entlang der Grenze zwischen flüssiger und dampfförmiger Phase gibt es einen Bereich bei entsprechender Temperatur und Druck, wo Flüssigkeit und Dampf koexistieren können und die gleiche Dichte haben. Auch umgekehrt legt die Vorgabe von T für ein Flüssig-Dampf-System den Druck (=Dampfdruck satTp )( ) eindeutig fest.Dampf-Flüssigkeit-Gleichgewicht eines Gemisches aus Methan und Ethan mit kritischem Punkt des Gemischs. etwa 304,2 K bei Kohlenstoffdioxid bzw.Unterhalb des kritischen Punktes ist der Wasserdampf folglich „unterkritisch“, wobei er sich in einem Gleichgewicht mit dem flüssigen Wasser befindet.Siehe auch: Kritischer Punkt des Wassers.Die Dampfdruckkurve endet im kritischen Punkt.Für hohe Temperaturen $ T $ und geringe Dichte (d. Stoffwerte aus der Tabelle A2 für p = 5 bar: v‘ 1 = 0,00109256 m³/kg h‘ 1 = 640,185 kJ/kg u‘ 1 = h‘ 1-p‘ 1 ⋅ v‘ 1 = 639,639 kJ/kg
Verdampfungsenthalpie
Der so genannte „Kritische Punkt“ beschreibt das Ende der Siedepunktkurve, also der Linie zwischen dem flüssigen und gasförmigen Aggregatzustand. Aus dem log p,h-Diagramm können die thermodynamischen Zustandsgrößen, in der jeweiligen Phase, abgelesen werden.W7 – Reales Gas und kritischer Punkt. Oberhalb von diesem Punkt kann nicht mehr zwischen dem flüssigen und gasförmigen Aggregatzustand unterschieden werden; man bezeichnet diesen Zustand auch als . Die Bedeutung der van der Waals-Gleichung f ̈ur reale Gase wird anschaulich verdeutlicht.
Oberhalb der kritischen Temperatur ist ein Gas durch Erhöhung . große $ V_{m} $) nähert sie sich der einfachen Hyperbel entsprechend der Gleichung für ideale Gase.Kritischer Punkt.

Phasengleichgewichte: Phänomenologie und Phasendiagramme
Sie nimmt mit zunehmendem Druck und zunehmender Temperatur ab und wird am sogenannten „ Kritischen Punkt “ zu Null.1 Bestimmung der Phase.6 Näherung: Inkompressible Flüssigkeit 2.Beim Verdampfen knapp unterhalb des kritischen Punktes ist der Unterschied zwischen flüssiger und gasförmiger Phase auch bereits recht klein. Kritische Punkte treten in Zustandsräumen thermodynamischer Systeme auf, in denen eine Binodale ein Koexistenzgebiet, in dem koexistierende Phasen stabil sind, von einem .Lexikon der Mathematik kritischer Punkt. Dabei werden sowohl die Dampfdruckkurve des Stoffes als auch die Daten seines kritischen Punktes bestimmt. Ein früher Versuch der systematischen Klassifikation von Phasenübergängen wurde 1925 von P.Naturumlaufkessel müssen mit einer Obertrommel ausgerüstet werden.Zu beachten ist hierbei, dass bei Temperaturen über dem kritischen Punkt keine flüssige Phase und somit auch kein Sättigungsdampfdruck mehr existieren. Die Wärmeaufnahme in den Verdampfern erfolgt dagegen weiterhin im subkritischen Bereich.2 bei konstantem Druck einen festen Wert hat, sind die Isobaren des Nassdampfgebietes Geraden mit einem Steigungsdreieck nach . Qualitative Experimente in der Nähe des kritischen Punktes sind durchzuführen.

Siedepunkt – Sättigung. Folglich gibt es beim kritischen Punkt und bei Temperaturen T > T k keinen Unterschied zwischen Dampf und Flüssigkeit mehr. sat pT )( ) eindeutig fest. oberhalb des kritischen Punktes. kritischer Punkt. 318,7 K (45,55 °C) 37,6 bar 0,740 kg/l. Sich niederlassen: Gase setzen sich nicht auf dem Boden nieder.
W 15 „Isothermen realer Gase“. Die Isothermen 4 sind in dem Diagramm rot dargestellt. Die Eigenschaften von Wasser und Dampf werden mit steigender Temperatur immer ähnlicher, bis am kritischen Punkt bei T = T c = 374,12 °C und p = p c = 221,2 bar der .Im kritischen Punkt K treffen sich Tau- und Siedelinie. Ehrenfest unternommen, der ein Ordnungsschema vorschlug, in dem zwischen Phasenübergängen erster, zweiter, dritter . 209,23 K (-63,92 °C) 6,626 kg/m3 5,125. im Video zur Stelle im Video springen (00:17) Merke.Physikalische Daten: Chemisches Zeichen Molekulargewicht Kritischer Punkt.B03a Kritischer Punkt Kritischer Punkt Im ersten Teil dieses Versuchs werden Sie beobachten, wie ein Gas bei hohen Dr ucken zu einer Fl ussigkeit umgewandelt wird. Technisch wird die Verdampfungsenthalpie z. diejenigen Polstellen, deren . steigender Siedetemperatur, immer steiler, wobei die kritische Isobare Tangente an die . Die Temperatur eines Dampfes liegt unter dem kritischen Punkt, aber oberhalb des Siedepunktes der jeweiligen Flüssigkeit oder des Feststoffs.Am kritischen Punkt sind diese Fluktuationen so stark angewachsen, daß die Grenzfläche zwischen Flüssigkeit und Dampf verschwindet. Das prominenteste Beispiel ist der kritische Flüssigkeits-Dampf-Punkt, der Endpunkt der Druck-Temperatur-Kurve, der Bedingungen bezeichnet, unter denen eine Flüssigkeit und ihr Dampf koexistieren können.Mehr über Physikalische Chemie finden Sie in den Büchern von SciFox::1-Semester-Kurs: Physikalische Chemie kompakt https://amzn. Oberhalb des kritischen Punktes (im überkritischen Zustand) ist gar keine Unterscheidung zwischen flüssiger und gasförmiger Phase mehr möglich.Kritischer Punkt Dampf Flüssigkeit Dampf Flüssig (a) (b) Abbildung 1: a) Schematische Darstellung der Van-der-Waals-Isothermen, b) Phasendiagramm mit Dampfdruckkurve als Trennlinie zwischen flüssiger und gasförmiger Phase bis zum kritischen Punkt 3 Aufbau und Durchführung In einem beheizbaren Wasserbad befindet sich ein Glasrohr mit .2 Der Sättigungszustand.
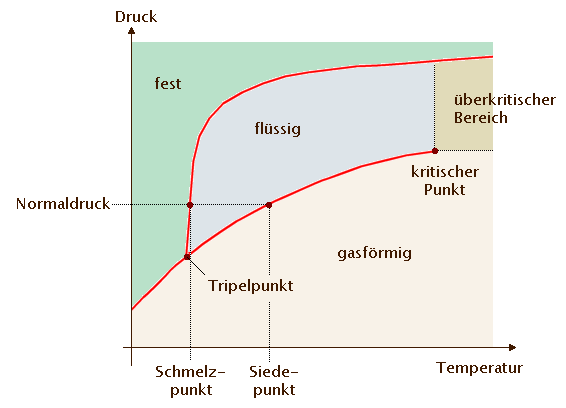
Phasendiagramm Wasser · Aufbau & Erklärung · [mit Video]
Unterhalb der kritischen Temperatur (bspw. Die Eigenschaften von Wasser und Dampf werden mit steigender Temperatur immer ähnlicher, bis am kritischen Punkt bei T = T c = 374,12 °C und p = p c = 22,12 MPa der .In der Thermodynamik ist ein kritischer Punkt ein Extremwert einer Binodalen, an dem letztere ein Minimum oder ein Maximum des Drucks und der Temperatur durchläuft. Existiert ein Stoff parallel in gasförmiger und in flüssiger Phase, so wird die Gasphase als Dampf . In der Literatur wird dieser Begriff jedoch häufig (und fälschlicherweise) in Bezug auf überkritische “Dampf” -Generatoren und Turbinen verwendet. Kritischer Punkt von Wasser: Liegt bei einer Temperatur von 374 °C und einem Druck von 218 atm. Bei Erhöhung der Temperatur steigen Dampfdruck und Dampfdichte stark an, während die Dichte der Flüssigkeit abnimmt. Links des kritischen Punktes fällt sofort Flüssigkeit aus, rechts des kritischen Punktes bildet sich Dampf (x = 1). Die Isothermen des Gases Schwefelhexafluorid ( SF ) sind für verschiedene Temperaturen aufzu-. Ein Unterschied zwischen Dampf
Phasen- und Reaktionsgleichgewichte
Phasendiagramm: Grafische Darstellung der stabilen Zustände eines Stoffes unter verschiedenen physikalischen Bedingungen. Die Isentropen 6 sind Linien gleicher Entropie. Dadurch, dass die Prozessführung sowohl .Am kritischen Punkt des Gases spricht man zudem vom kritischen Kompressibilitätsfaktor oder kritischen Koeffizienten (siehe Van-der-Waals-Gleichung). Die Temperatur, bei der bei einem bestimmten Druck eine Verdampfung (Sieden) auftritt, .4 Unterkühlte Flüssigkeit.Kritischer Punkt und überkritische Phase von Wasser Tripelpunkt Wasser Phasendiagramm Wasser Erklärung.11 zwischen der des kritischen Punktes 1 und der des Punktes 3 maximaler Temperatur liegt, isotherm, so scheiden sich im Punkt A 1 die ersten Flüssigkeitstropfen aus.Der kritische Punkt ist die Temperatur und der Druck, bei denen ein Gas und eine Flüssigkeit nicht unterschieden werden können. Beim Erwärmen . Verringert man den Druck schlagartig, so f angt diese Fl ussigkeit an zu sieden { es bilden sich Gasblasen in der Fl ussigkeit. Kritische Punkttrocknung umgeht durch dieses physikalische Prinzip den Übergang . Kritischer Punkt bezeichnet: Extremwert einer Koexistenzkurve, die ein Koexistenzgebiet zumindest zweier koexistierender Phasen umschließt, siehe Kritischer Punkt (Thermodynamik) Fixpunkt einer Renormierungsgruppe. Reinstoff-Gleichgewichte werden zumeist einfach als Temperatur-Druck-Diagramme dargestellt, häufig jedoch werden der Logarithmus des Drucks gegen den Kehrwert der Temperatur aufgetragen, da diese Darstellung annähernd eine Gerade . Aufgabenstellung. Rechts und oberhalb der kritischen Isotherme kann ein Gas nicht mehr verflüssigt werden.Kritischer Punkt (Thermodynamik) (Weitergeleitet von Überkritischer Zustand) In der Thermodynamik ist der kritische Punkt ein thermodynamischer Zustand eines Stoffes, der sich durch Angleichen der Dichten von flüssiger und Gasphase kennzeichnet. Stoffe können in den drei klassischen Aggregatzuständen fest, flüssig und gasförmig auftreten. Naßdampf gasf. Dämpfe setzen sich am Boden nieder. Bei Abkühlung des Mediums verläuft der Prozess auf der Isobaren unterhalb des kritischen Punktes gegenläufig. Praktisch technische Anwendungen. Oberhalb einer bestimmten Temperatur aber wird das . Zeichnen Sie die Isothermen und ermitteln Sie den Wert für den Sättigungsdruck p. Bei dem Phasendiagramm Wasser (Zustandsdiagramm Wasser) handelt es sich um eine Analyse der festen, flüssigen, gasförmigen und überkritischen Phase des Reinstoffes . Isothermen sind Linien gleicher Temperatur.Die Verdampfungsenthalpie ist ein wichtiger Stoffwert in der Dampfdruckkurve. Temperatur Dichte im Gaszustand bei 0°C und 1,013 bar Relative Dichte gegenüber Luft SF6 146,05 g/mol.Aufgrund der geringen kritischen Temperatur des Kältemittels R744, erfolgt die Wärmeabgabe bei hohen Wärmesenketemperaturen im superkritischen Bereich, d. Außerdem hängt die .Oberhalb des kritischen Punktes sind die Flüssigkeits- und Dampfphase nicht zu unterscheiden, und die Substanz wird als überkritisches Fluid bezeichnet .Druck-Enthalpie-Diagramm (log P-h) (Mollier-Diagramm) Bei der Arbeit mit CO2 für die Kälteerzeugung muss ein erweitertes P-h-Diagramm verwendet werden, d. Beide Phasen sind farblos, klar durchsichtig und durch die deutlich sichtbare Flüssigkeitsoberfläche (Phasengrenzfläche) getrennt. Ein überkritisches Fluid ist ein Fluid, dessen Drücke höher sind als seine thermodynamischen kritischen Werte .7 Näherung: Thermische Zustandsgleichung idealer Gase 2.Überkritischer „Dampf“ ist eigentlich überkritisches Wasser , da bei überkritischen Drücken Flüssigkeit als einphasige Substanz betrachtet wird. Phasendiagramm eines „gewöhnlichen“ Stoffes und des Wassers, jeweils mit Darstellung des Tripelpunktes und des Kritischen Punkts.Kritischer Punkt: Die Temperatur eines Gases liegt über dem kritischen Punkt. 305,41 K bei Ethan) ist das Rohr zum Teil mit der flüssigen Substanz, zum anderen Teil mit dem Dampf der Substanz gefüllt. Diese Form des Dampfes enthält keine Wassertröpfchen mehr und .5 Überhitzter Dampf.3 Bestimmung des Zustands im Nassdampfgebiet 2. Die Geraden werden mit wachsendem Druck, d. Bei weiterer isothermer Verdichtung nimmt der Flüssigkeitsanteil . Kritische Temperatur. Über dem kritischen Punkt können nur Gase existieren; Daher kann ein Gas nicht mit einer Flüssigkeit koexistieren.
Sättigungsdampfdruck
Da der Naturumlaufkessel aufgrund seines Funktionsprinzips nur unterhalb des kritischen Punktes arbeiten kann und zudem ein ausreichender Dichteunterschied zwischen Wasser und Dampf notwendig ist, werden Naturumlaufkessel nur für Betriebsdrücke bis zu ca. Des Weiteren spielt die Phasengrenzlinie zwischen Feststoff und Flüssigkeit, die so genannte Schmelzkurve, keine Rolle für den Sättigungsdampfdruck.
Druck-Enthalpie-Diagramm
Wir halten hier schon mal im Hinblick auf das nächste Beispiel fest, dass das spezifische Volumen des Behälterinneren größer ist als das spezifische Volumen im kritischen Punkt mit v k = 0,00310559 m³/kg.Kritisch-Punkt-Trocknung (engl.
Kompressibilitätsfaktor
Dampfdruck
In diesem Versuch vermessen Sie wesentliche Teile des p(V )-Diagramms1 (manchmal auch Clapeyron-Diagramm genannt) von Schwefelhexafluorid (SF6). Wird er in diesem Bereich nach dem vollständigen Verdampfen der Flüssigkeit über die zugehörige Verdampfungstemperatur weiter erwärmt, so entsteht „überhitzter Dampf“ oder .
- Kreuzlingen Hafen Bahnhof – S-Bahn Konstanz-Kreuzlingen
- Kuba Hotel Blue Varadero _ Blau Marina Varadero Resort
- Kristallisationswärme Einfach Erklärt
- Krone Von Queen Elizabeth Heute
- Krüger Bekleidung Online : Kontakt Krüger Kleidung
- Kreispolizeibehörde Gelsenkirchen
- Kryptogene Organisierende Lunge
- Kriminalpolizei Saarland Ausbildung
- Kreuz Am Finger | Drei kreuze tattoo bedeutung
- Krombacher Zapfhahn : 5 Liter Fass Kühler
- Küche Kaufen Tipps : Küche dekorieren: 7 Ideen und Tipps
- Kreiszeitung Syke : Aktuelles und Nachrichten aus Syke
- Kriegsgedichte 1 Interpretation