Hybridisierung In Der Chemie , Alkohole: Formeln, Herstellung & Eigenschaften
Di: Samuel
Wir kennen bereits die elek-tronische Struktur von Atomen im Allgemeinen, wir wissen um Orbitale und ihr Aussehen und wir kennen die wichtigsten Bindungstypen. Problematisch wird es jedoch, sobald mehr als ein Valenzelektron an der Reaktion beteiligt ist.Vier sp 3 -Orbitale richten sich tetraedrisch in gleichem Winkel zueinander aus.Die Hybridisierung der Sauerstoffatome in O3 kann durch Berücksichtigung der Anzahl der Sigma-Bindungen und freien Elektronenpaare um jedes Sauerstoffatom bestimmt werden. Diesen Modellierungsvorgang nennt man Hybridisierung der Orbitale. Ein Atom kann promoviert werden, damit es mehr . Tetrafluormethan, CF 4 Hybridisierung. Dies wird Ihnen helfen, die elektronische Struktur und Bindung des Moleküls zu verstehen. Sie besteht aus einem zentralen Kohlenstoffatom (C), zwei Sauerstoffatomen (O) mit jeweils einer Einfach- und Doppelbindung vom Kohlenstoff ausgehend und einem Wasserstoffatom. Aromaten – Aromatische Kohlenwasserstoffe.
Radikal (Chemie)
In diesem Video lernst du eine Erklärung zur {sp}^3 sp3 -Hybridisierung am Beispiel des Methanmoleküls kennen. Pauling geprägter Begriff zur Charakterisierung bestimmter Bindungsverhältnisse. Es ist ein mathematisches Verfahren, das die Erzeugung von gemischten Elektronenorbitalen durch eine lineare Kombination der entsprechenden Wellenfunktionen beinhaltet.Das Zeichnen der NH3-Lewis-Struktur (Ammoniak) erfordert ein paar einfache Schritte. sp 3-Hybridisierung: Ein kugelförmiges s- und drei hantelförmige p-Orbitale verbinden sich miteinander (ein Beispiel hierfür ist Methan (CH 4)).
Chemische Hybridisierung sp, sp2, sp3
Der sp 3 -Zustand ist nicht der einzige Hybridisierungszustand, den das Kohlenstoffatom erreichen kann.
Molekülorbitaltheorie
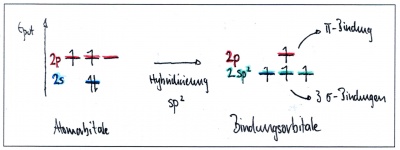
Die Bindungsverhältnisse eines Moleküls der 2. Die Tatsache, dass die genauen Ergebnisse meistens mit Hilfe einfacher paarweiser Überlappung neu interpretiert werden können, manchmal vielleicht .Meine Zählrichtung der Hybridisierungen geht schrittweise vom ganz linken C – Atom zum rechten C – Atom: ⇒ sp 2 sp 2 sp 3 sp 3.Carboxylgruppe einfach erklärt.Hybridisierung, Bastardisierung, die bei vielen Elementen beim Eingehen einer Bindung auftretende Mischung von Atomorbitalen zu Hybridorbitalen, die auf Grund ihrer exzentrischen Gestalt günstige Voraussetzungen für eine Überlappung haben und die Forderung nach minimaler Gesamtenergie des Moleküls erfüllen. Seine chemische Formel ist C3H8O4 und sein hoher Siedepunkt ist aufgrund von ionischen Bindungen und nicht aufgrund von Wasserstoffbrücken. Aber wie sieht es aus, wenn sich 1 Kohlenstoffatom mit z. Universität; Schule. Ein Beispiel dafür ist der Kohlenstoff, der im Grundzustand . Beschreibe die Bildung der Kohlenstoff-Kohlenstoff-Einfachbindung. Willkommen bei Studocu Logge dich ein, um Zugang zu den besten Studienressourcen zu erhalten.Hybridisierung.Der Text dieser Seite basiert auf dem Artikel Hybridisierung aus der freien Enzyklopädie Wikipedia und ist unter der Lizenz „Creative Commons Attribution/Share Alike“ verfügbar. Zentrales Sauerstoffatom: Das zentrale Sauerstoffatom in O3 ist an 3-Sigma-Bindungen beteiligt und verfügt über 1 freies Elektronenpaar.Verbinden Sie alle Elemente, die in der Struktur vorhanden sind.Ein p-Orbital verbleibt in der Form und dem Energieniveau unverändert.Gemäß der VSEPR-Theorie stoßen sich die vorhandenen Stickstoffatome gegenseitig ab und ordnen sich in einem linearen Muster an. Als Promotion wird der Vorgang bezeichnet, bei dem Elektronen in höher liegende Orbitale bewegt werden und sich die Atome dementsprechend im angeregten Zustand befinden. Informationen zu den Urhebern und zum Lizenzstatus eingebundener . In der Theorie klingt das bisher alles noch einfach. Denn die einzelnen Elektronen eines Atoms verteilen sich unterschiedlich in der Elektronenhülle. [1] Solche Doppelbindungen findet man in den funktionellen Gruppen von Alkenen, Aldehyden, Ketonen, Estern, Thioketonen, Iminen, Sulfoxiden usw.Steht beispielsweise das p-Orbital senkrecht auf der x-y-Ebene, liegen die sp 2 – Orbitale symmetrisch in der x-y . Bücher; Entdeckung. Einfach-, Zweifach- und Dreifach-Bindungen des Kohlenstoffs. Dies führt zu Bindungswinkeln von 180°. Dabei kannst du die Elektronenhülle auf zwei Arten genauer beschreiben: Die sp 2-Orbitale ordnen sich trigonal-planar an (in einem 120° Winkel), das übrig gebliebene p-Orbital steht senkrecht zu ihnen.Wenn zwei Kohlenstoff-Atom eine Doppelbindung eingehen wollen, so müssen die beiden Kohlenstoff-Atome jeweils ein p-Orbital besitzen. Da Kohlenstoff für die organische Chemie eine besondere Rolle spielt, soll an dieser Stelle genauer auf die Bindungsverhältnisse des Kohlenstoffatoms eingegangen werden. Vorlesung, Freitag, 14. Unterscheide zwischen der {sp^3} sp3 -Hybridisierung und der {sp^2} sp2 -Hybridisierung.
Hybridorbital
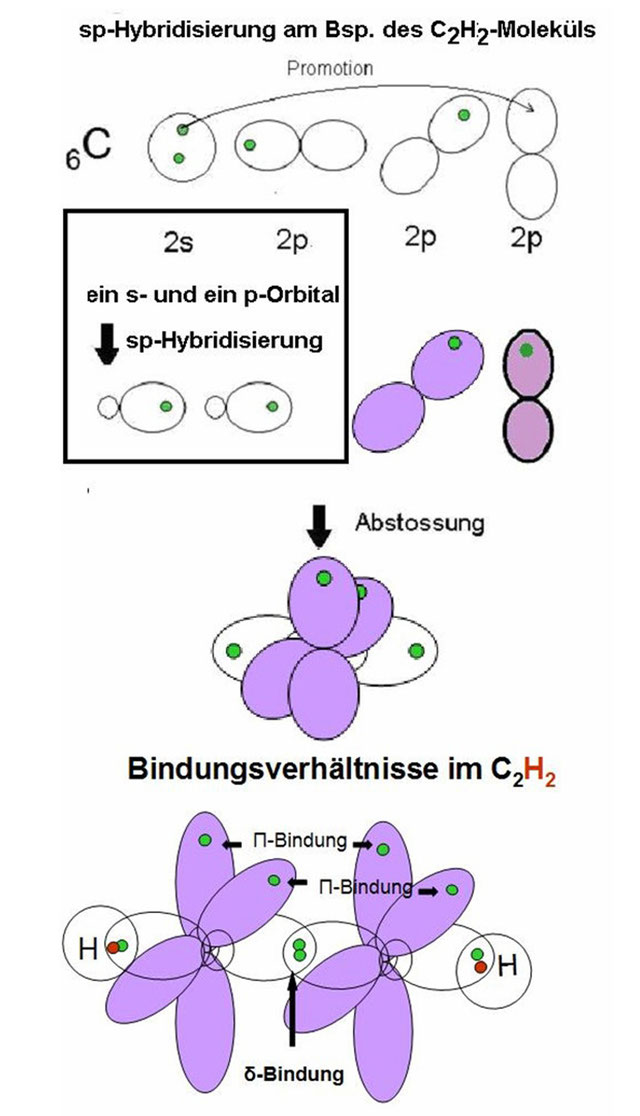
– und sp-Hybridisierung. Weiter zum Dokument. (Weitergeleitet von Π-Bindung) Eine Doppelbindung ist eine Form der chemischen Bindung, bei der zwei Atome über zwei verschiedene Atombindungen verknüpft werden.Schülern der Stufen EF oder Q1 kann man diese komplexen Zusammenhänge leider nicht nahebringen, es sei denn, es handelt sich um ausgesprochene Experten. Um die chemische Bindung zu verstehen, müssen wir einsame Elektronenpaare und Bindungspaarelektronen in einem Molekül identifizieren. An der Bildung von CN- sind zwei .Eine Doppelbindung, bindet zwei Atome über zwei Atombindungen, meist eine σ- und eine π-Bindung aneinander. Grund dafür ist die Aromatizität, welche vorliegt, wenn eine Verbindung folgende Charakteristika . Lewis-Struktur hilft, die Anordnung der Valenzschalenelektronen in einem Molekül zu visualisieren.
Hybridorbitale
Bindungskonzepte in der Organischen Chemie
Schritt dazu: 3. Vergleiche auch: Elektronenkonfiguration des Kohlenstoff-Atoms im Überblick. Hybridorbitale im Kohlenstoff. Erhitzen der Hybrid-DNAs.Glycerin ist ein vierwertiger Alkohol, der in kosmetischen Produkten aufgrund seiner glättenden Eigenschaften verwendet wird. Die vereinten Orbitale haben eine unterschiedliche . Wenn sich nun die beiden sp 2-hybridisierten Kohlenstoff-Atome binden, .
Hybrid-Orbital
Bei einer Hybridisierung ordnen sich die Orbitale der beteiligten Atome zu neuen, energetisch günstigeren Orbitalen (sog. Bei der Bildung von sp-Hybridorbitalen bleiben zwei p . Das Kohlenstoffatom bildet vier {sp}^3 sp3 -Hybridorbitale aus, die sich mit den s s -Orbitalen der Wasserstoffatome überlappen. Ein Hybridorbital ist ein Orbital, das rechnerisch aus einer Linearkombination der Wellenfunktionen der grundlegenden Atomorbitale entsteht.Kohlenstoff ist im Regelfall vierbindig.Diese Struktur hat keine Doppelbindung, daher könnte das Molekül keine . Bindungen am Kohlenstoff sind Atombindungen. Je nachdem wieviele Nachbarschaftsatome der . Allerdings muss hier berücksichtigt werden, dass es auch Elemente gibt, die durch Hybridisierung vor der Bindung in einen energetisch höheren Zustand angeregt werden, so dass hier die Zahl der einfach besetzten Hybridorbitale zählt. Das Konzept wurde . Da die Elektronen den weitmöglichsten Abstand voneinander einnehmen, entsteht eine .Die chemische Hybridisierung ist die Mischung der Atomorbitale, deren Konzept 1931 vom Chemiker Linus Pauling eingeführt wurde, um die Unvollkommenheiten der Theorie der Verbindung von Valencia (TEV) abzudecken. Die chemische Formel für Cyanid ist CN-. Das Konzept wurde von Linus Pauling um 1931 .Bereiche der Chemie » Organische Chemie » Zu Beginn » Kovalente Bindungen » Einfach-, Zweifach- und Dreifach-Bindungen des Kohlenstoffs. Energetisch ist die Ausbildung solcher Orbitale zunächst ungünstig, bei Elementen der 4.: +49 (0)69 7982 9130 Email: schwalbe@nmr.

Nehmen wir einfach mal die C – Atome des 2-Buten unter die Lupe: H 3 C – CH = CH – CH3.Es wird normalerweise in der äußeren Hülle eines Atoms gefunden.
NH3-Lewis-Struktur: 5 einfache Schritte zum Zeichnen, Hybridisieren!
Valenzbindungstheorie – Hybridisierung der Orbitale .Wissen der Allgemeinen Chemie zurückgreifen. Die Molekülorbitaltheorie (kurz MO-Theorie) ist eine von zwei komplementären Möglichkeiten den Aufbau von Atombindungen zu beschreiben, die andere Möglichkeit ist die VB-Theorie.Radikal (Chemie) Als Radikale bezeichnet man in der Chemie Atome oder Moleküle mit mindestens einem ungepaarten Valenzelektron.

Harald Schwalbe Institut für Organische Chemie und Chemische Biologie Goethe Universität Frankfurt Tel. Das Molekulargewicht von CN- beträgt 26. Lassen Sie es uns aufschlüsseln: Zählen Sie die Valenzelektronen: Stickstoff (N) gehört zur Gruppe 15 des Periodensystems, was bedeutet, dass es 5 . Radikale werden mit einem „Punkt“ dargestellt, der das ungepaarte Elektron symbolisiert, zum Beispiel Stickstoffmonoxid (NO • ).Ob ein C – Atom sp 2, sp 3 oder sp hybridisiert ist, hängt davon ab, wie groß die Anzahl der Partner ist, mit denen das Atom eine Bindung eingehen kann. (00:13) Die Elektronenkonfiguration gibt die Elektronenverteilung in einem Atom an. In NH4+-Lewis-Struktur, das Molekül ist sp 3 hybridisiert und hat einen Bindungswinkel von 109. vier Wasserstoffatomen verbindet? Wie sieht das Molekül. Das Kohlenstoffatom hat in seiner äußeren Schale 4 Elektronen (Elektronenkonfiguration: 2s . Die beiden C – Atome sind sp2 hybridisiert, weil sie jeweils lediglich mit drei Atomen eine .ORGANISCHE CHEMIE 1. Nenne die Art der {\sigma} σ . Die Carboxylgruppe (-COOH) ist die funktionelle Gruppe der Carbonsäuren. Schlüsselthemen • . CN- hat eine sp-Hybridisierung. Die Liste der Autoren ist in der Wikipedia unter dieser Seite verfügbar, der Artikel kann hier bearbeitet werden. Aus diesem Grund vereinfacht man das Ganze zum positiven induktiven Effekt und sagt, dass Alkylgruppen ihre Elektronen in Richtung auf das radikalische C-Atom schieben. sp 2-Hybridisierung:.
Hybridisierung von beliebigem Atom bestimmen
N3– Hybridisierung: Um die Hybridisierung des Zentralatoms zu identifizieren, die Lewis-Struktur des Azid-Ions muss untersucht werden. Beim MO-Verfahren werden die Atomorbitale der beteiligten Atome ‚vermischt‘. Wenn ein s-Orbital mit zwei p-Orbitalen hybridisiert, dann erhält man drei sp 2-Orbitale.Schulchemie im Kontext, von Klasse 7 bis zum Abitur, für Sekundarschulen und Gymnasien.nimmt mit zunehmendem s-Anteil bei der Hybridisierung mit p-Orbitalen zu. (A) nur 1 ist richtig (B) nur 2 ist richtig (C) nur 3 ist richtig (D) nur 1 und 3 sind richtig (E) 1–3= alle sind richtig .
Einfach-, Zweifach- und Dreifach-Bindungen des Kohlenstoffs
sp3-Hybridisierung.
Molekülorbitaltheorie
Mit dem p-Orbital und einem der sp . In der Chemie bedeutet aromatisch, dass eine ungesättigte cyclische Verbindung, die eigentlich wie andere Cycloalkene reagieren sollte (z. Die Verschmelzung von Atomorbitalen eines Atoms zu neuen Orbitalen wird als Hybridisierung bezeichnet. Vorlesung: Hybridisierung, Hückel-MO . Bei einer Verwandtschaftsanalyse kommt nun noch ein 3. Die molekulare Geometrie von CN- hat eine lineare Form.
Alkohole: Formeln, Herstellung & Eigenschaften
Die Molekülorbitaltheorie (kurz MO-Theorie) ist neben der Valenzstrukturtheorie (VB-Theorie) eine von zwei komplementären Möglichkeiten, die Elektronenstruktur von Molekülen zu beschreiben. Um jetzt herauszufinden, wie hoch der Grad der Verwandtschaft ist, muss das Gemisch noch einmal erhitzt werden. Die meisten Radikale sind besonders reaktionsfreudig.Die sp 2 – Orbitale richten sich senkrecht zum übrig gebliebenen p-Orbital aus. CN- ist von Natur aus polar.Heute im Chemieunterricht: | Bindigkeit . Hybridisierung Kovalente Bindungen Der Begriff der Säure.sp-Hybridisierung: Ein s-Orbital verschmilzt mit einem p-Orbital zu einem keulenförmigen Hybridorbital; sp 2-Hybridisierung: Hybridisierung eines s-Orbitals und zweier p-Orbitale. (3) Die Acidität von Kohlenwasserstoffen nimmt mit zunehmendem s-Anteil bei der Hybridisierung mit p-Orbitalen in der Reihenfolge sp3 -Hybridisierung. Hier entsteht ein DNA: RNA -Hybrid. Die Promotion widerspricht der Regel, dass niedrige Orbitale zuerst besetzt werden. Die perfekte Prüfungsvorbereitung! In diesem Online-Kurs zum Thema Chemie wird dir in 45 anschaulichen Lernvideos, 284 leicht verständlichen Lerntexten, 745 interaktiven Übungsaufgaben und 809 druckbaren . Periode mit Doppelbindung lassen sich mit sp 2 Hybrid-Orbitalen beschreiben. Theoretische Chemie.Molekülorbitaltheorie. Sind nur 2 der 3 p-Orbitale an der Hybridisierung beteiligt, entstehen die so genannten sp 2-Orbitale. Lerne mit 29 Alkohole Karteikarten in der kostenlosen . Gesamtvalenzelektronen in CF 4 = 4+7×4 = 32 Elektronen. Ein Hybrid-Orbital ist ein Orbital, das rechnerisch aus einer Linearkombination der Wellenfunktionen der grundlegenden Atomorbitale entsteht. Man kann sich ganz gut merken, dass sp 2 Hybridisierung des Kohlenstoffs zu Doppelbindungen hinführt, sp 3 Hybridisierung zu Einfachbindungen und schlussendlich die sp Hybridisierung zu .Elektronenkonfiguration einfach erklärt.Übung fk institut für chemie modul che105 allgemeinen und anorganischen chemie stud. Dies ist bei der sp 2-Hybridisierung der Fall:. Die Anfänge der Arbeiten zu diesem Thema gehen auf das Jahr 1931 zurück, als Linus Pauling die Antwort auf die Struktur von Methan vorschlug – . In der Chemie entsteht die . Interaktive Unterrichtshilfe für Schülerinnen und Schüler; Plattform für Lehrerinnen und Lehrer der Chemie (didaktischer Austausch im Forum, Online-Shop mit Unterrichtsmaterialien).5 0, also ist die Form des Moleküls tetraedrisch. Welche Unvollkommenheiten? Dies sind die Molekülgeometrien und die äquivalenten Verbindungslängen in Molekülen wie .Mit den Aufgaben zum Video Einfachbindungen, Mehrfachbindungen und Hybridisierung kannst du es wiederholen und üben. Beim MO-Verfahren werden die Orbitale aller Atome vermischt und spalten sich dabei in bindende und antibindende, über das . Verwendung der sp lewis-Struktur. Dieser Artikel enthält die NH4+-Lewis-Struktur und ihre Hybridisierung, Form, Bindungswinkel und detaillierte Erklärungen. Damit gehört die Verbindung zu der . Brom addieren), dies nicht tut.Das aromatische System.Unter Hybridisierung wollen wir im allgemeinen die Kombination von Atomorbitalen am gleichen Atom verstehen, und das ist eher die Regel als die Ausnahme, wenn wir eine MO-Berechnung durchführen. Bei der sp2-Hybridisierung verbindet sich das s-Orbital mit zwei p-Orbitalen; das übrige p-Orbital bleibt im ursprünglichen Zustand. sp3-Hybridisierung, Ausbildung tetraedrisch angeordneter Orbitale (Winkel von 109,5°), die quantenmechanisch einen Mischzustand zwischen dem s-Orbital und den drei p-Orbitalen darstellen.Heute im Chemieunterricht: | Kohlenstoff . In der Organi-schen Chemie benötigen wir überwiegend die polare und die unpolare kova-lente Bindung.Promotion von Elektronen.Ein typischer Vertreter .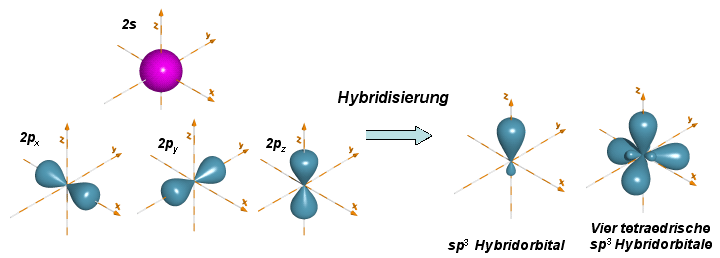
Hybridisierung (Chemie) aus dem Lexikon
Einfachbindungen, Mehrfachbindungen und Hybridisierung
Die Hybridisierung von Kohlenstoff (Orbitalmodell