H2O Oxidationszahl | Oxidationszahl von CO? (Schule, Chemie, Oxidation)
Di: Samuel
Oxidationszahl von O2 (Chemie, Sauerstoff)
Die Oxidationszahl von H ist + 1 (Regel 1). Die Oxidationszahl von O2 sollte doch kleiner sein als die vom O in H2O damit es aufgeht, aber O2 ist ja ein Molekül, das nur aus einem Atom besteht und sollte die Oxidationszahl 0 haben.

Hi, nein, die Oxidationszahl von Sauerstoff ist -II.Die Oxidationszahl von O in Verbindungen ist normalerweise -2, aber es ist -1 in Peroxiden.
Oxidationszahl von CO? (Schule, Chemie, Oxidation)
Die hier dargestellte Liste ist eine Ausgliederung aus dem Hauptartikel: Oxidationszahl.
Redoxgleichung von Methanol und Wasserstoffperoxid
Es wird in der Regel nach hinten geschrieben, Beispiel H2O. H+1 2O-1 2 + K+1Mn+7O-2 4 → Mn+4O-2 2 + K+1O-2H+1 + O0 2 + H+1 2O-2. Oxidationszahlen sind also Ladungen oder (meist) fiktive Ionenladungen eines Atoms. Beim Molekül sind die Atome nicht allein, sondern . Es ist daher wichtig die Oxidationsstufe (=OXZ) eines Atoms/Ions bzw. Gleichungen:
Welche Oxidationszahl hat Mn2+? (Chemie, Oxidationszahlen)
Was sind die Oxidationszahlen in der Verbindung H2O2?
Gleichungen:
Liste der Oxidationsstufen der chemischen Elemente
Regeln: – Ungebundene Atome, (molekulare) . Oxide entstehen, wenn Elemente oder Verbindungen mit elementarem Sauerstoff (Oxidationszahl 0) reagieren (Ursprung des . Die Summe der Oxidationszahlen aller Atome eines mehratomigen Ions ist gleich der Ladung dieses Ions. a) Die Oxidationszahlen von jedem Atom werden festgelegt. Handelt es sich . Oft wird erst durch die Bestimmung der .
Oxidations-Reduktionsmittel und Oxidationszahlen
Man kann sich das Bleichmittel kaufen und das ausprobieren. In chemischen Verbindungen nominell -2, selten -1. Bei positiver Oxidationszahl: die Elektronen . Aluminium ist 3 fach positiv.
Oxidationszahl bestimmen von S+HNO3
Die Methode wird darauf aufgebaut, dass die Erhöhung der Oxidationszahlen von Reaktanten, die oxidiert wurden, muss gleich zur Anzahl der Reaktanten sein, die reduziert wurden.Du solltest das aber grundsätzlich verstehen lernen, denn das Auswendiglernen von Oxidationszahlen ist völlig sinnlos – schließlich sind um die 10 Mio chem.Anweisung für das Aufstellen von Redoxreaktionen. Die Übertragung der Elektronen von einem Atom auf ein anderes zeigt sich daran, dass sich die Oxidationszahl des einen (das Elektronen abgibt) erhöht, die des anderen (das Elektronen aufnimmt) verringert. ὀξύς, oxýs ‚scharf‘, ‚spitz‘, ‚sauer‘) sind Sauerstoff-Verbindungen eines Elements, in denen der Sauerstoff die Oxidationszahl −2 hat. Mn2+ (+II) H2O: H2 (+I)O (-II) ergibt dann 2 1-2=0.Die Summe der Oxidationszahlen aller Atome einer mehratomigen neutralen Verbindung ist gleich 0.Nomenklatur von Komplexverbindungen. Die Oxidationszahl von O2 sollte doch kleiner sein als die vom O in H2O damit es aufgeht, aber O2 ist ja ein Molekül, das nur aus einem Atom . Schwefel ist 6 positiv, Sauerstoff ist 2 negativ. Wenn du jetzt aber zum Beispiel O2 im Wasser drin hast, dann ist es -II.Oxidationszahlen (Abkürzung: OXZ) Bei jeder Redoxreaktion ändern sich die Oxidationszahlen der beteiligten Stoffe.Die Oxidationszahl des Schwefels ergibt sich zu +6, denn seine Formalladung kompensiert die Summe der Oxidationszahlen der Sauerstoffatome (-8) bis auf die zweifach negative Ionenladung. Diese werden jedoch bei den einzelnen Elementen, bei denen . b) Alle Redox-Paare von Atomen, die oxidierten (deren Oxidationszahl . (1) Die Summe aller Oxidationszahlen eines Moleküls stimmt immer mit dessen Ladung überein. c) Die Redox-Paare werden in zwei Halbreaktionen . Schritt: Die Redoxreaktion wird in Halbreaktionen aufgeteilt. Die Oxidation (auch Oxydation) ist eine chemische Reaktion, bei der ein Ion oder ein Atom (als solches oder als Bestandteil eines Moleküls) ein oder mehrere Elektronen abgibt und dadurch seinen Oxidationszustand erhöht. Nur als Begleittext zur Vorlesung geeignet.Mit Hilfe der Oxidationszahlen wird bestimmt, wie viele Elektronen aufgenommen werden.Und das Wassermolekül aus zwei Wasserstoffatomen und einem Sauerstoffatom (hinter dem o könnte auch eine eins stehen) Zwei O-Atome (sind aber als O2 in einer Verbindung) und 2 H-Atome ( sind mit einem O-Atom in einer Verbindung) Es gibt das O-Atom und das O2-Molekül. b) Die Redox-Paare in der Reaktion werden identifiziert.7 Regeln zum Bestimmen von Oxidationszahlen (OZ) (1) Die Summe der Oxidationszahlen eines Moleküls muss immer dessen realer Gesamt-Ladung entsprechen. Beim Erhitzen im Stickstoff strom bildet sich Lithiumnitrid.Gegeben ist eine Oxidation: O2 –> H2Ound eine Reduktion: MnO4- –> Mn2+. Stattdessen wird eines der Elektronen aus der .Oxidationszahl einfach erklärt.
6 Reduktionen und Oxidationen
Leider gibt es auch unangenehme Fälle von Wasserstoff udn Sauerstoffverbindungen die zeigen das die Regeln untereinander verschiedenrangig sind. Nun sollen die Oxidationszahlen bestimmt werden und die Gleichungen mit H2O und H+ oder H3O+ ergänzt werden. Sauerstoff hat fast immer die -II. Bei der Ermittlung der Oxidationszahl gelten folgende Regeln: Fluor erhält stets die Oxidationszahl -1.1x O = -II Also ganz einfach: H2O ist: 2 – 2 = 0. Pro Wasserstoffperoxid-Molekül werden also zwei Elektronen aufgenommen, da zwei Sauerstoff-Atome vorhanden sind. Versuch 1: Nachweis von Wasserstoffperoxid in Haarbleichmitteln Wir lösen 1 g Titanylsulfat in 5 ml Schwefelsäure (c = 0,1 mol/l).HNO3 + e- + H+ —> NO2 + H2O . Wie Du schon wissen solltest ist die Gesamtsumme in einer stabilen chemischen Verbindung immer null. Dadurch können wir sagen: Bei negativer Oxidationszahl: Atom zieht die Elektronen näher an sich. Hierbei sind die Elektronegativit äten ausschlaggebend.Übung: Redoxreaktion aufstellen.

Für die Benennung von Komplexverbindungen hat die IUPAC bestimmte Regeln aufgestellt.Wir haben in der Schule gelernt, dass man mithilfe der Oxidationszahlen feststellen kann, ob es sich bei der vorliegenden Reaktion um eine Säure-Base Reaktion oder um eine Redoxreaktion handelt. Generell werden Komplexteilchen folgendermaßen benannt: Erst die Anzahl der Liganden, dann die Namen der Liganden, schließlich der Name des Zentralteilchens mit seiner Oxidationszahl. Ausnahmen: -1 bei . 136 R C H H H R C H OH H R C H O R C OH O Erhöhung der Oxidationszahl um 2 Einheiten pro Schritt – 2 e– – 2H+ – 2 e– – 2H+ – 2 e– – 2H+ H2O .Die Oxidationszahl gibt die formale Ladung eines Atoms in einer Verbindung an. Verbindungen bekannt. jedes Bestandteils einer Verbindung zu kennen, da sie Auskunft darüber gibt, ob es/sie als Oxidations- oder Reduktionsmittel reagiert.Für die Bestimmung der Oxidationszahlen gibt es einfache Regeln. Das Stickstoffatom nimmt ja schließlich kein Elektron auf. Die Erhöhung des Oxidationszustandes wird formal durch die Erhöhung der sogenannten Oxidationszahl .
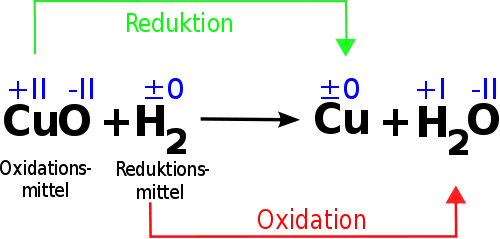
Die Änderung der Oxidationszahlen ist das charakteristische Merkmal von Redoxreaktionen. Am besten ist es, wenn Du eine neutrale Verbindung nimmst, in der das Dichromation enthalten ist, also z.
Was bedeuten die Zweier bei o2 und h2o?
Also neutral geladen plus das wir die Oxidationszahlen bestimmt haben. Das tropfen wir zu einer möglichst farblosen Lösung, in der wir H 2 O 2 vermuten. Diese Ladungen werden nach bestimmten Regeln zugewiesen. Die Oxidationszahlen habe ich wie folgt bestimmt (stehen in Klammern).
Oxidationszahlen/CuSO4 (Schule, Chemie)
Als Beispiel zum Beispiel die Reaktion: Cu + 2 H2SO4 —> CuSO4 .Die Methode der Veränderung von Oxidationszahlen ist ein ziemlich einfaches und leichtes Verfahren für das Ausbalancieren der Redoxgleichungen. Der manchmal verwendete Name Difluoroxid für diese Verbindung ist falsch, weil Sauerstoff in Oxiden eine negative . Beispiel 1: Eisen(III)-oxid und Kohlenstoffmonoxid reagieren im alkalischen Milieu zu Eisen und Kohlenstoffdioxid. Ist das Molekül ungeladen, ist die Summe der Oxidationszahlen gleich 0. Also Moleküle die ausschließlich aus denselben Atomen bestehen tragen immer die Oxidationszahl 0. Die Summe der Oxidationszahlen aller Atome eines Moleküls (mehratomiges „Ion“ mit Ladung Null) ist . Es ist das elektronegativste Element in der Formel. Es gehört zu den Sauerstofffluoriden und ist einer von sehr wenigen Stoffen, in dem Sauerstoff mit einer positiven Oxidationszahl auftritt. Die Oxidationszahlen dienen bei Redoxreaktionen dazu, die Vorgänge besser zu erkennen.Wasserstoff bekommt in vielen Fällen die Oxidationszahl +1, außer wenn Wasserstoff mit elektropositiveren Atomen verbunden ist (oder mit sich selbst).Eine Redoxreaktion liegt vor, wenn bei einer chemischen Reaktion eine Übertragung von Elektronen zwischen den Reaktanten stattfindet, wodurch eine Änderung der Oxidationszahlen auftritt. Gleichungen:
Redoxreaktion: Beispiel, Definition, Chemie
Sie führt alle bekannten chemischen Elemente mit den ihnen zugeordneten Oxidationszahlen auf. Die Oxidationszahl des Sauerstoff-Atoms verringert sich von \(\ce{-I}\) auf \(\ce{-II}\). Das Oxonium-Ion ist einfach positiv geladen und die Summe der Oxidationszahlen muss der Ladung entsprechen. Die sulfatgruppe ist zwei negativ. Schritt: Man schreibt die nicht aufgestellte Reaktion auf. In einer Verbindung erhält immer nur ein Element die negative Oxidationszahl.

Die Summe der Oxidationszahlen aller Atome in einer neutralen Verbindung ist 0.

Oxidationszahl
Ausnahmen sind CH4 und NH3. Das finde ich aber ziemlich schwer sich vorzustellen.Die Oxidationszahl (oder Oxidationsstufe) ist die Maßangabe der Oxidationsstufe von einem Atom in einem Molekül (siehe: Die Regeln für die Bestimmung von Oxidationszahlen ).Oxide (ältere Schreibung und auch allgemeinsprachlich Oxyde; von griech. Wenn du das weißt H2O2 Ist Wasserstoffperoxid, können Sie Sauerstoff sofort mit ON = -1 belegen.Dafür gibt es einige Regeln, mit deren Hilfe man nahezu alle Oxidationszahlen aller Atome/ Moleküle und Ionen bestimmen kann. Die Oxidationszahlen sind OZ (K) = +I und OZ (O) = -II.

Oxidationszahlen H3O+? (Schule, Chemie, Universität)
Oxidationszahlen sind formale Größen zur Beschreibung von Redoxreaktionen. Die folgenden Oxidationszahlen habe ich bereits herausgefunden:MnO4-: Mn (+VII)O4 (-II) ergibt dann 4 -2+7=-1 die Ladung des . Damit muss Stickstoff die Oxidationszahl +5 haben, denn 1 + 5 – 6 = 0

Sauerstoffdifluorid ist ein Fluorid des Sauerstoffs mit der Summenformel OF 2. Das untersuchen wir auf die Anwesenheit von Wasserstoffperoxid. Lithiumhydrid beginnt bei 900-1000 °C, sich in elementares Lithium und Wasserstoff zu zersetzen und ist damit das bei weitem hitzebeständigste Alkalihydrid. In den folgenden Redoxreaktionen Übungen kannst du dein Können auf die Probe stellen: . [6] 2 LiH → 900 − 1000 o C 2 Li + H 2 ↑. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Oxidationszahlen: +III -II +II -II 0 +IV -II Reaktionsgleichung: Fe 2 O 3 + CO ⇢ Fe + CO 2; Oxidation: 3 CO + 6 . Sie werden in römischen Ziffern über die Elementsymbole geschrieben.CH 2 O + LiH + H 2 O CH 3 OH + LiOH. Schule, Chemie. Bei komplexeren .H2O: H2(+I)O(-II) ergibt dann 21-2=0. Ein Beispiel hierfür ist die Reaktion von Magnesium (Mg) mit Sauerstoff (O₂), wobei Magnesiumoxid (MgO) entsteht: 2 Mg + O₂ → 2 MgO. Sauerstoff erhält die Oxidationszahl -2. (2) Die Oxidationszahl eines einfachen Ions . Auf die Auflistung gebrochen-zahliger Oxidationszahlen wird aus Platzgründen verzichtet.Chemie auf die Oxidationszahl verschiedener funktioneller Gruppen. Als Zwischenstufen entstehen Lithiumamid . Woher ich das weiß: Studium / Ausbildung. (2) Einzelne Atome in Reaktiongleichungen erhalten immer die Oxidationszahl null, . K₂Cr₂O₇, das Kaliumdichromat. Da sich die Oxidationszahl von Stickstoff von V auf IV nimmt es ein Elektron auf, welches mit einem H-Ion ausgeglichen werden muss.Sauerstoff im Molekül hat die Oxidationszahl 0. Da die hier +1 ist, muss Sauerstoff -II haben, denn +III-II = +1.Die Oxidationszahl eines einatomigen Ions ist identisch mit seiner Ionenladung. Die Oxidationszahlen Heterolyse ermittelt. Wenn man Wasser als Beispiel nimmt, kann man theoretisch die Bindungen zerteilen und erhält einzelne Ionen, die die gleiche Ladung wie die Oxidationszahlen haben.Die folgenden Oxidationszahlen habe ich bereits herausgefunden:MnO4-: Mn (+VII)O4 (-II) ergibt dann 4 -2+7=-1 die Ladung des gesamten Ions. Ist ein Molekül neutral geladen, muss die Summe der Oxidationszahlen null ergeben, OZ = 0. Bei dem Dichromation musst Du zur Bestimmung der Oxidationszahlen auch noch die Ladung mit betrachten.
- Haba Kugelbahn Große Grundpackung
- Haftbefehl _ Haftbefehl
- Hadura – Export the Hasura GraphQL Schema
- Haare Aus Spenderbereich – Haartransplantation Spenderbereich
- Haare Entfernen Sugaring – Waxing & Sugaring: Studio in München-Schwabing
- Haare Auf Der Brust Gefährlich
- Gw2 Behälter Mit Eingefangenem Blitz
- Gw2 Treasures Wegweisende Rüstung
- Haarpflege Oldenburg Innenstadt
- H | The Letter H
- Haferflocken Für Baby , Haferflocken für Abendmilchbrei
- Haare Von Blond Auf Rot Färben
- Gw2 Legendary Insight Guide _ Guide zur legendären Rüstung
