Elektrolyse Überspannung Tabelle
Di: Samuel
Elektrodenreaktion [electrode reaction] Die an einer Elektrode ablaufende elektrochemische Reaktion (siehe auch: Zellreaktion).de Eine Kupfer(II)-chloridlösung wird mit verschiedenen Elektrodenmaterialien elektrolysiert.
ZERSETZUNGSSPANNUNG UND ÜBERSPANNUNG
Überspannungen führen zu einem Störfall oder Fehlerfall, wenn sie Bauelemente oder Bestandteile der Anlagen zerstören. Im Rahmen der Elektrochemie gibt es im Prinzip zwei Elektrodenreaktionen, bei denen sowohl elektrische als auch chemische Phänomene zu beobachten sind. Die nachfolgenden Tabellen geben einen kurzen Überblick bezüglich der Überspannung bei der anodischen Sauerstoffentwicklung und der kathodischen Wasserstoffentwicklung (die Versuche wurden jedoch bei verschiedenen . Die Differenz zwischen dem Abscheidungspotential und dem Elektrodenpotential nennt man Überpotential bzw. Kategorie : Elektrochemie Dieser Artikel basiert auf dem Artikel Zersetzungsspannung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation . Die Polarografie (ein Sonderfall der Voltammetrie) ist ein elektrochemisches Verfahren zur qualitativen und quantitativen Analyse von chemischen Elementen und Verbindungen, vor allem Ionen und Molekülen in einer Lösung. Die Überspannungen sind bei .
Zersetzungsspannung
Zersetzungsspannung und Überspannung Die Spannung, die man anlegen muss, damit die eigentliche Elektrolyse überhaupt beginnt, wird als Zersetzungsspannung bezeichnet.Elektrochemische Spannungsreihe – Tabelle.
Elektrolyse von Salzsäure
Durch Anlegen einer Zersetzungsspannung können die Vorgänge zwischen zwei Halbzellen eines galvanischen Elements umgekehrt werden. Lehrbuch der Physikalischen Chemie“, 5. TU Clausthal Institut für Physikalische Chemie Praktikum Teil A und B 11. 2) Das Standardpotential ist somit das Maß für das Oxidations- und Reduktionsvermögen von Teilchen in wässriger Lösung. Aufgabe 2: Die erweiterte Redoxreihe .
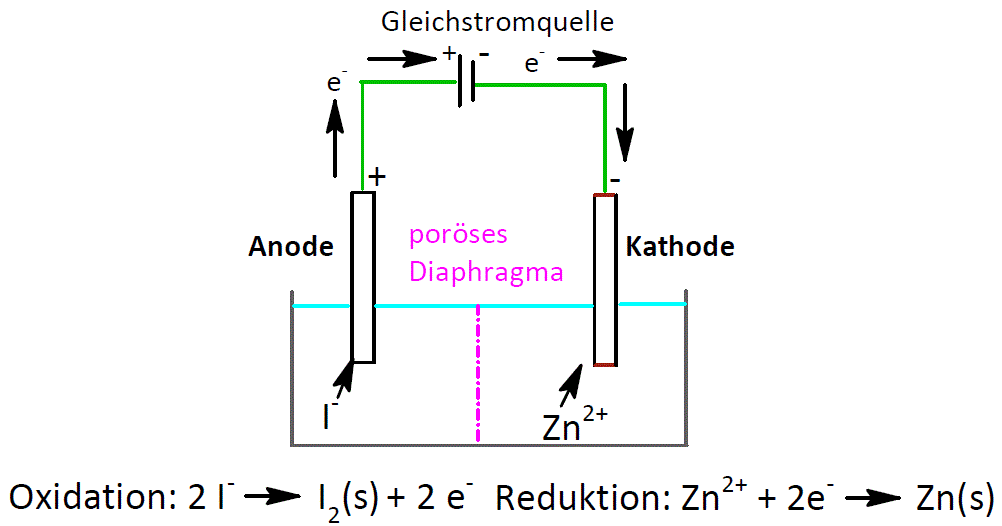
Elektrolyse [electrolysis] Als Elektrolyse bezeichnet man die chemische Reaktion von Substanzen an den Elektroden unter Stromzufuhr.Bei einigen Elektrolysen benötigt man eine höhere Spannung als nach dem Elektrodenpotential berechnet. Die Zellspannung ist die elektrische Spannung einer einzelnen elektrochemischen Zelle, d. Überspannung, Elektrodenpolarisation, die Abweichung der Galvani-Spannung einer stromdurchflossenen Elektrode vom unbelasteten Wert. Obwohl prinzipiell dieselben Endprodukte hergestellt werden, laufen bei den . Du findest sie in den gängigen Tafelwerken oft in Tabellenform.
Überspannung
Elektrolyse als erzwungene Redoxreaktion
Untersuchen Sie in einem ersten Versuch, mit welcher Mindest spannung man die Elektrolyse von Salzsäure (c = 1 mol ∙ L -1 ) durchführen muss, damit Elektrolyseprodukte in ausreichender 1 Menge entstehen. Sowohl an der Kathode als auch an der Anode können Überspannungen auftreten und somit die benötigte Spannung erhöhen. Fließt kein elektrischer Strom durch die .Die ältesten Verfahren der Chloralkali-Elektrolyse sind das Diaphragma-Verfahren und das Amalgamverfahren, sie wurden beide bereits Ende des 19. Kinetik der Elektrodenvorgänge und des Stofftransports (Geschwindigkeit des Ladungsübergangs, Konvektion, Migration im elektrischen Feld, .
Elektrochemische Spannungsreihe
Elektrochemie – Testfragen/-aufgaben 1. Aufgabe Bestimmen Sie die Zersetzungsspannung von Salzsäure (HCl) . Cu2+-Ionen werden dafür leichter reduziert als Zn2+-Ionen und sind stärkere Oxidationsmittel. ZERSETZUNGSSPANNUNG Stand 22. Alfred Flint Inhaltsübersicht Gesamtkonzept Von der Strom . Das Beispiel der Elektrolyse von Salzsäure zeigt den Effekt der Überspannung . Bei dieser Spannung beginnt die Zersetzung des Elektrolyten durch elektrische .Der Vorgang der Überspannung ist wissenschaftlich noch nicht genau geklärt, aber die Mehrheit der Experten geht von einer Art Aktivierungsenergie aus. Damit die Zersetzung eines Elektrolyten stattfindet, muss eine Zersetzungsspannung angelegt werden, welche von der berechneten Spannung aus den . Die Zersetzungsspannung wird .
Elektrolyse
2 mit ihren Teilreaktionen für die hydrogen evolution reaction (HER) und oxygen . Das Wichtigste auf einen Blick.Die Elektrolyse als erzwungene elektrochemische Reaktion.Zersetzungs- und Überspannung: Die experimentell ermittelbare Spannung, ab der sich ein Stoff in der Elektrolyse zu zersetzen beginnt, wird Zersetzungsspannung genannt.Das bedeutet, dass die Elektrolyse von Gasen, also beispielsweise die Zersetzung von Säuren und die anschließende elektrolytische Gasproduktion, nur dann effektiv möglich ist, wenn die Überspannung . Jetzt kann angegeben werden, welche Reaktionen bei der Elektrolyse ablaufen müssen (siehe 3) 5. Laufen an einer Elektrode mehrere Elektrodenreaktionen ab und sind diese alle im Gleichgewicht, so ist die Überspannung aller Reaktionen .Überspannung (Elektrotechnik) Überspannung ist eine elektrische Spannung in elektrischen Systemen, die den Toleranzbereich deren Nennspannung überschreitet.Elektrochemie 1.Überspannung Spannung, die zusätzlich zur Zersetzungsspannung aufgebracht werden muss, sodass eine Elektrolyse stattfindet.3 Elektrochemie im Gleichgewicht Wedler G.Die Überspannungen sind bei Gasbildungen (z.
Standardpotenziale
Thermodynamische Grundlagen der Elektrochemie (Elektrodenpotential, potentialbestimmende Reaktion, elektrochemisches Gleichgewicht, Nernst-Gleichung, Helmholtzsche Doppelschicht).Überspannung ist eine elektrische Spannung in elektrischen Systemen, die den Toleranzbereich deren Nennspannung überschreitet. Ordnet man korrespondierende Redoxpaare nach der Größe ihres experimentell bestimmten Standardpotentials, erhält man die sogenannte elektrochemische Spannungsreihe (vgl. Überspannungen führen zu einem Stör- oder Fehlerfall, wenn sie Bauelemente oder Bestandteile der Anlagen zerstören.3 mit ihren Teilreaktionen für die hydrogen evolution reaction (HER) und oxygen . Sowohl an der Kathode als auch an der Anode können Überspannungen auftreten und somit die benötigte Spannung gegenüber den Berechnungen nach der Nernst-Gleichung erhöhen.Die elektrochemische Spannungsreihe. keine quantitativen Stoffabscheidungen: Faradaysche Gesetze sind nicht im Lehrplan. Die dritte Variante, der Membranprozess, wurde erst um das Jahr 1970 technisch realisiert.
Polarographie
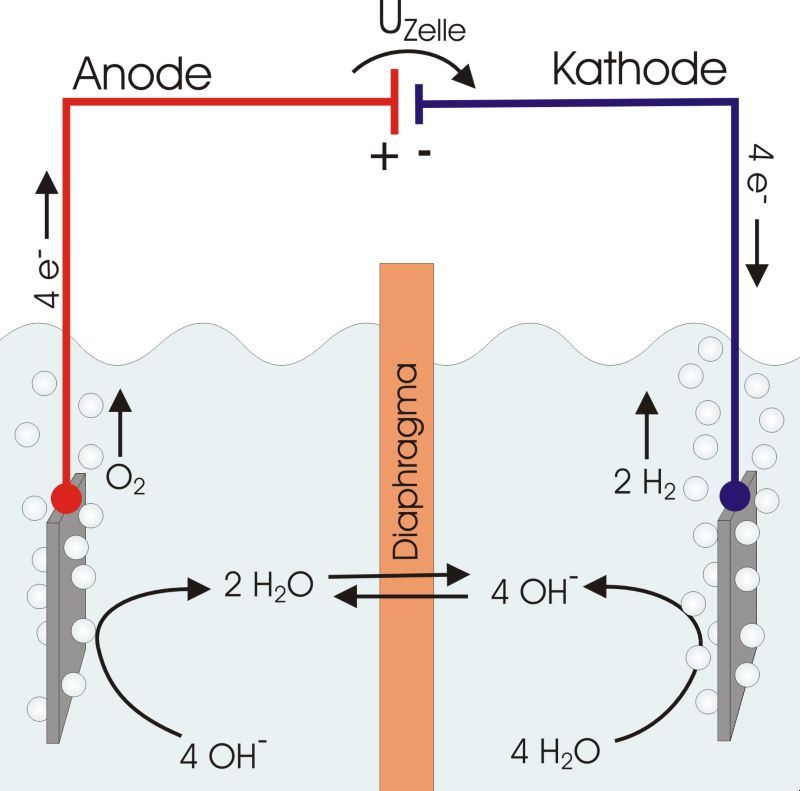
Wasserstoff- und Sauerstoffbildung) . eines galvanischen Elements (einschließlich der umgangssprachlich als Batterien bezeichneten Primärzellen, der Akkumulatoren und Brennstoffzellen) oder einer Elektrolyse zelle. Hohe Überspannungen erhält man z.wünschte Richtung gezwungen werden. Jahrhunderts eingeführt. Für die aufgeführten Werte der Redoxreihe gelten unter folgenden Bedingungen: – Bezugselektrode: Normal-Wasserstoffelektrode, – Temperatur: 25 °C bzw.H2O →1/2 O2 + 2 H + + 2 e – Bei starken pH-Änderungen während der Elektrolyse muss also die anzulegende Spannung laufend erhöht werden, um eine konstante Stromstärke aufrecht zu erhalten oder die Stromstärke sinkt im Laufe der Elektrolyse bei konstanter Spannung ab.Die zyklische Voltammetrie ist ein klassisches Untersuchungsverfahren der Elektrochemie, . c) Soweit erforderlich berücksichtigt man auch die Überspannungen.; In der Elektrochemie ist die Überspannung die Differenz zwischen der Gleichgewichts-Galvanispannung und der . Diese chemische Zersetzung mit Hilfe eines elektrischen Gleichstroms bezeichnet man als Elektrolyse.
Alexander Witt Prof.
Zersetzungsspannung: Durch Elektrolyse entsteht eine galvanische Zelle, deren Potential erst überwunden werden muss. Die meisten Standardelektrodenpotentiale (oder auch Standardpotential) wurden bereits bestimmt.Zersetzungsspannung.Dazu schreibt man sofort das entsprechende Normalpotential in eine Tabelle.Elektrode wird zusätzlich von Überspannungen bestimmt. Dabei kommt es zur . Überspannungen können symmetrisch, das heißt, . Zersetzungsspannung einfach erklärt Viele Elektrochemie-Themen Üben für Zersetzungsspannung mit Videos, interaktiven Übungen & Lösungen. 2: Überpotentiale (E Ü) an verschiedenen Elektroden bei der Chloralkalielektrolyse Elektrodenmaterial E Ü (Cl 2) in V E Ü (O ) in V . Da eine Brennstoffzelle .5 Kennlinie Brennstoffzelle Abbildung 4: Typische Kennlinie einer Brennstoffzelle mit Unterscheidungen in drei Bereiche Eine ideale Brennstoffzelle ist eine Konstantspannungsquelle mit , was auch die Mindestspannung für die Elektrolyse von Wasser ist.Elektrolyse als erzwungene Redoxreaktion.
Leitfähigkeit und Überspannung bei der Elektrolyse
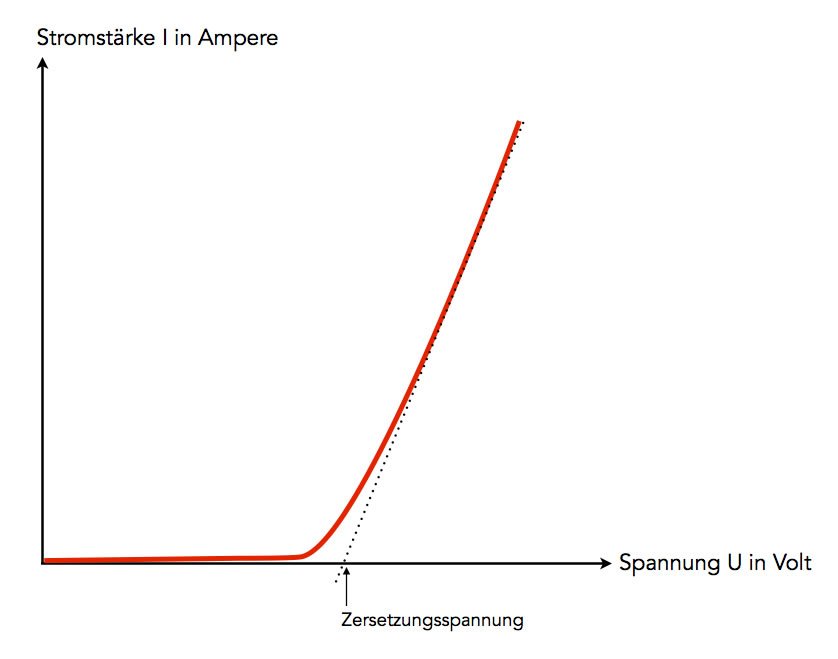
Die Zersetzungsspannung hängt von mehreren Faktoren ab, die wichtigsten Faktoren sind die Zusammensetzung des Elektrolyten, also des zu elektrolysierenden Salzes, sowie . Rücklauf wird die Sauerstoff-Belegung mit einer Überspannung von mehreren 100 mV redu-ziert. Während bei der Voltammetrie mit stationären Elektroden gearbeitet wird, werden bei der Polarographie .2 Bei Elektrolysen spielt das verwendete Elektrodenmaterial aufgrund auftretender Überspannungen eine große Rolle.Tabelle 1:Typische Wirkungsgrade einiger Maschinen oder Prozesse 2. Im Gegensatz zur . Zum einen die Reaktion, bei der durch eine freiwillig ablaufende Reaktion elektrische Energie erzeugt wird. Bei der Verwendung der Daten solltest du beachten, dass diese unter Standardbedingungen erhoben wurden.Tabelle: Elektrochemische Spannungsreihe. Ab ERHE = 350 mV belegt sich die Oberfläche wieder mit atomarem Wasserstoff. Unter der Zersetzungsspannung versteht man in der Elektrochemie die zur Durchführung einer Elektrolyse mindestens benötigte Differenz der Elektrodenpotentiale von Anode und Kathode. Dabei wird die elektrische Spannung (U) langsam erhöht und mit einem Strommessgerät die Stromstärke (I) gemessen. (Weitergeleitet von Abscheidungspotenzial) Unter der Zersetzungsspannung versteht man in der Elektrochemie die zur Durchführung einer Elektrolyse mindestens benötigte Differenz der Elektrodenpotentiale von Anode und Kathode. Sie ist abhängig vom Elektrodenmaterial und von der (oder den) ablaufenden Reaktion(en). Bereich 20 < ERHE < 800 mV Die vergrößerte Aufnahme dieses Teils des .8 Elektrochemische Thermodynamik .Galvanische Zellreaktion ist durch Elektrolyse umkehrbar E 210 LI E 220 AB oder E 240 AB E 230 LI (LowCost-Leitfähigkeitsprüfer, Bauanleitung) 25-26 Zersetzungs- und Überspannung LV: Stromstärke-Spannungskurve der Elektrolyse von Salzsäure
Zyklische Voltammetrie: Kinetik elektrochemischer Reaktionen
Überspannungen können symmetrisch (d. zwischen beiden Zuleitungen) oder .

Für die Elektrolyse einer Natriumchlorid-Lösung ist eine deutlich höhere Zersetzungsspannung notwendig. Konzeptbaustein: Von der „Strom leitenden“ Kartoffel zur Elektrolyse – Einführung in die Elektrochemie – ein schülerorientiertes Konzept zur Behandlung des Themas Elektrochemie – – Stand: Dezember 2016 – Universität Rostock Institut für Chemie . Was ist die Grundidee der Elektrochemie? Die Elektrochemie ist das Studium der chemischen Prozesse, die elektrischen Strom verursachen und durch ihn beeinflusst werden.Der Begriff Überspannung hat verschiedene Bedeutungen: . Die Zersetzungsspannung liegt also bei 4,07 Volt. Aufgabe 1: Redoxreihe der Metalle Zink ist unedler, hat die kleinere Ionisierungsenergie, wird leichter oxidiert und ist ein stärkere Reduktionsmittel als Kupfer. (++) Gut geeignet, (+) geeignet, (−) nicht geeignet Überspannung.Heute im Chemieunterricht: | Elektrolyse . Startseite; Knower werden; Download; Support; Unternehmen. Bei dieser Spannung beginnt die Zersetzung des Elektrolyten durch elektrische Anziehungskräfte, die zwischen den Elektroden . Bei Metallen kann . Die Zersetzungsspannung sollte theoretisch der Zellspannung des zugehörigen galvanischen Elementes unter Berücksichtigung der . Auch die Metallionenkonzentration der Lösung . Erhöhen Sie dazu die angelegte Spannung schrittweise und notieren Sie die gemessene Stromstärke. I Der Widerstand eines Leiters ist proportional seinem spezifischen Widerstand ρ, der Länge l und umgekehrt proportional dem Querschnitt q R . Das liegt vor allem an dem stark negativen Redoxpotenzial von Natrium (-2,71 Volt) und dem etwas positiveren Redoxpotenzial von Chlor (+1,36 Volt).Eine wachsende Stromstärke erhöht leicht die Überspannung, eine Temperaturerhöhung senkt dagegen die Überspannung. Die Überspannung bezeichnet die Potentialdifferenz zwischen dem Potential einer Elektrode bei Stromfluss und dem Gleichgewichts-Elektrodenpotential bei einer Elektrolyse.e 045 AB Tabelle der Standardelektrodenpotenziale Bezug zu Problemen aus vorangegangenen Stunden 9/10 Strom aus Redoxreaktionen – ein historischer Rückblick Batterie von Bagdad Galvanis Froschschenkelversuche Arbeitsteilige Textarbeit, Erstellen von Plakaten, Präsentation Die folgende Tabelle gibt die Überpotentiale an verschiedenen Elektroden wieder: Tab. Diese Überspannung η ist die Abweichung des Elektrodenpotentials bei Stromfluss vom Gleichgewichtspotential φ 0 (?=?−?0). b) Dann berechnet man das wirkliche Potential mit Hilfe der Nernst’sche Gleichung. In der Elektrotechnik versteht man darunter das Auftreten einer Spannung, welche die Nennspannung eines elektrischen Systems überschreitet (siehe Überspannung (Elektrotechnik)).
Elektrolysen
Durch den verwendeten Elektrolyten ergeben sich die drei relevanten Verfahren der Wasserelektrolyse, die in Abb. Überspannung: Differenz zwischen berechneter und tatsächlicher Zersetzungsspannung, Erklärung des Phänomens auf Teilchenebene.
Elektrolyse (allgemein)
Sie beinhaltet sowohl das Studium der Chemie in Bezug auf Elektrizität als auch die Verwendung von elektrischem Strom, um . bei der Abscheidung von Gasen.Die Wasserzersetzung durch Elektrolyse besteht aus zwei Teilreaktionen, die durch einen ionenleitenden Elektrolyten getrennt sind. 298,15 K, – effektive Konzentration c = 1 mol l .Stromstärke-Spannungs-Kurve bei Elektrolysen und Überspannung C3CL ⭳ : laborberufe. Lösungen zu den Aufgaben zur Elektrochemie. Presse; Für Unternehmen; Karriere; Tech bei KnowunityDie Elektrolyse von Wasser; Leitfähigkeit und Überspannung Leitfähigkeit Nach dem Ohmschen Gesetz ist der Spannungsabfall gleich dem Produkt aus der Stromstärke im Leiter und seinem Widerstand U = R .Lexikon der Physik Überspannung.
- Elite Model Wikipedia _ Naomi Campbell
- Elektro Steffen Schönberg Wikipedia
- Elmer Gantry Filme Youtube _ Elmer Gantry final scene
- Elefantengras Als Sichtschutz | China Schilfgras Aksel Olsen
- Elisabeth Maas Haus Home Page – Haus am Urselbach: Home
- Else If Javascript : Tutorial Javascript Dasar #08
- Elektromotor Bezeichnung – Gleichstrommaschine
- Elektronische Signatur In Word Einfügen
- Elemental Water Vanilla : Elemental Invasions in WoW Classic
- Elke Seefried Biografie – Seefried
- Elektronische Gangschaltung Rennrad