Dipolmolekül Einfach Erklärt | Dipol in Physik
Di: Samuel
Polare Bindungen lassen sich deutlich machen, indem man die Elektronenbewegung verfolgt.Als Dipol-Dipol-Kräfte oder Dipol-Dipol-Wechselwirkungen werden die Kräfte bezeichnet, die zwischen Molekülen herrschen, die ein permanentes elektrisches Dipolmoment besitzen (für die magnetische Dipol-Dipol-Wechselwirkung, z. elektrischer Ladungen oder beim . So ermöglicht Wasser Lebensräume für viele Organismen. Das Wichtigste auf einen Blick.

Die Elektronenpaarbindung bildet sich zwischen zwei Nichtmetall-Atomen aus.Die besonderen Eigenschaften von Wasser (H 2 O) sind für das Leben auf der Erde entscheidend.Ammoniak ist ein stechend riechendes, giftiges Gas.Die Erklärung für dieses Verhalten ist einfach: In dem inhomogenen elektrischen Feld richten sich die Dipole des Wassermoleküls so aus, dass sie zum Kamm hin zeigen.Kovalente Bindung einfach erklärt Wie entsteht eine Atombindung? Was ist eine polare Atombindung? Atombindung am Beispiel vom Wassermolekül Geometrie Bindungslänge Bindungsarten in der Chemie Kovalente Bindung einfach erklärt.Die Erklärung der Phänomene ist eigentlich einfach, dennoch hätte ich so deutliche Beobachtungen nicht erwartet. Hier ist es jedoch eher unüblich, von einer cis- oder trans-Isomerie zu sprechen, da es sich bei Cyclohexan, um einen Ring handelt.Dipol-Dipol-Wechselwirkung einfach erklärt Die Dipol-Dipol-Wechselwirkung ist die stärkste der Van-der-Waals-Kräfte und gehört damit zu den zwischenmolekularen Kräften. NH 3 ist eine der meist produziertesten Chemikalien und dient als Grundstoff für weitere Stickstoffverbindungen (z.Als Dipol-Dipol-Kräfte (auch Dipol-Dipol-Wechselwirkungen, Keesom-Kräfte oder Keesom-Wechselwirkungen genannt) werden die Kräfte bezeichnet, die zwischen Molekülen herrschen, die ein permanentes elektrisches Dipolmoment besitzen (für die magnetische Dipol-Dipol-Wechselwirkung, z. Während die Quellen anderer physikalischer Felder durchaus Monopole sein können, sind bei Magnetfeldern bisher nur Dipole beobachtet .Wasserstoffbrückenbindung – einfach erklärt. ethyl alcohol) hat die Summenformel C 2 H 6 O.Ethanol (abgekürzt: EtOH; engl. Zwischenmolekulare Wechselwirkungen sind Wechselwirkungen, die zwischen Molekülen (z. Deshalb wird es auch Dichteanomalie des Wassers . Viel Spaß ? Dirk Unkauf Musik Song of Mirrors von Unicorn Heads Ethylalkohol, Essigsäureethylester, Ethylacetat, Essigsäurebutylester, .Chemische Bindungen: Übersicht aller Bindungen Primär- und Sekundärbindungen inter- & intramolekular mit kostenlosem Video Die Elektronenpaarbindung wird auch als Atombindung bezeichnet., es hat eine positive und eine negative Ladung an gegenüberliegenden Enden aufgrund der ungleichen Elektronegativität der Atome.
Intermolekulare Kräfte
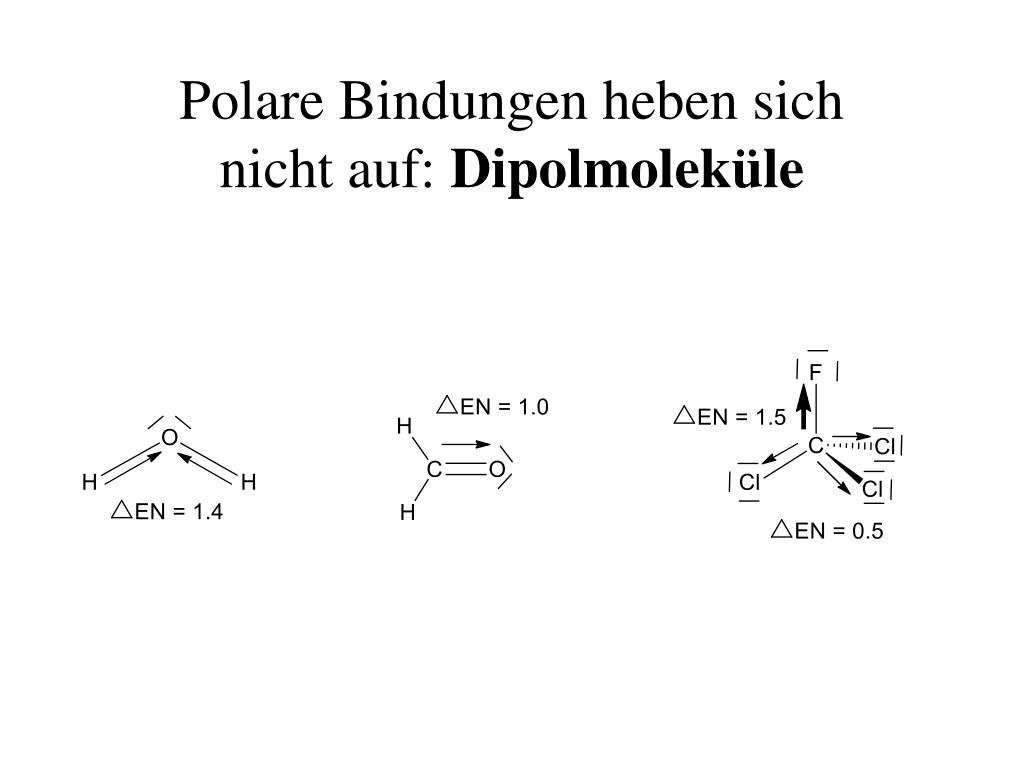
Man unterscheidet dabei anhand der Differenz der Elektronegativität in unpolar, schwach polar, stark polar und Ionenbindungen. Die beiden pole . Dabei ist es egal, ob es sich um bindende oder nichtbindende Elektronenpaare handelt.
Dipol (Physik)
Das elektronegative Atom ist häufig . Das liegt vor allem am speziellen Aufbau der Wassermoleküle und den Kräften, die zwischen den einzelnen Wassermolekülen wirken.Vektor eines Dipols, der aus zwei gegensetzlichen Ladungen beliebiger Art besteht. Sie entsteht dadurch, dass sich positive und negativ geladene Ionen elektrostatisch anziehen.Die Anomalie des Wassers beschreibt, dass das Volumen von Wasser beim Abkühlen nur bis zu einer Temperatur von 4°C sinkt und dort sein Minimum erreicht. Salpetersäure HNO 3 ).

Also ich hab das gefühl ich habs falsch, irgendwie macht meine erklärung nicht so sinn. Eine Wasserstoffbrückenbindung ist eine Form der Anziehung zwischen Molekülen, also eine zwischenmolekulare Wechselwirkung. Sie sorgt dafür, dass Atome in chemischen Verbindungen fest zusammengehalten werden. Es gibt die Van-der-Waals-Krafte, die Dipol-Dipol-Wechselwirkungen, die . Denn Äthanol besitzt eine Hydroxygruppe (OH). Diese Moleküle zeigen ausgeprägte, unsymmetrische Ladungsverteilungen der Elektronen, auch wenn das Molekül nach außen hin elektrisch neutral ist.
Was sind Dipolmoleküle?
Hier und im kurzen Video erklären wir dir alles, was du über die Alkane wissen musst: vom Aufbau über Eigenschaften und Benennung bis zur Verwendung.be/_OrIOEFjYIUAutor: Chemie Endlich Verstehen
Dipolmolekül
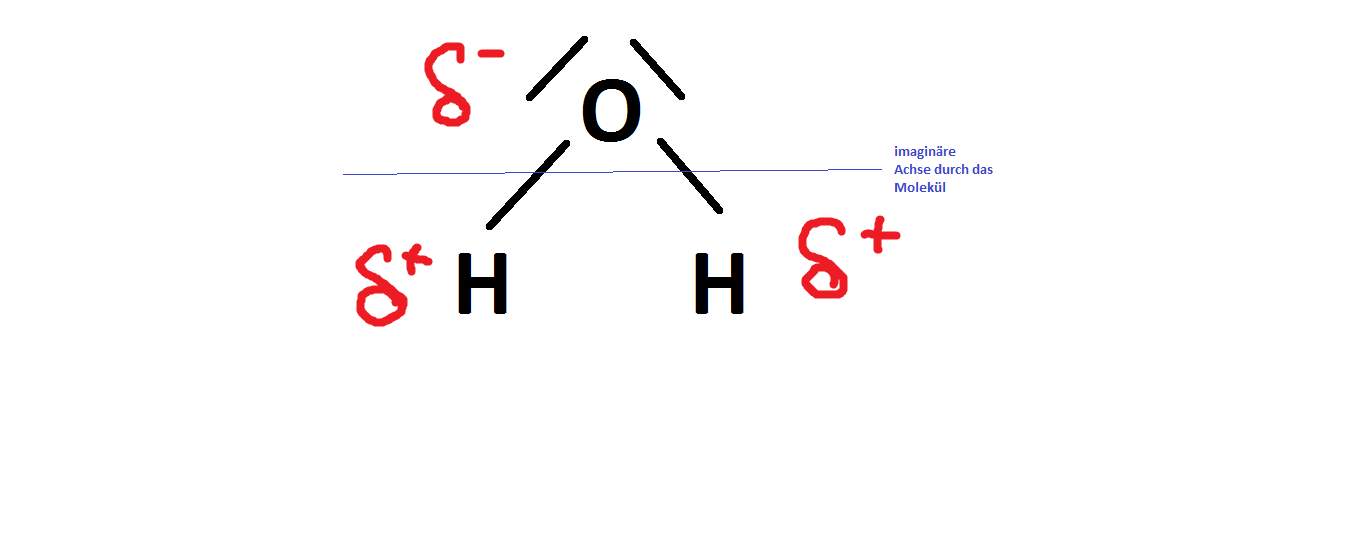
Die Chemie unterscheidet zwischen zwei verschiedenen Bindungsarten: I) Primärbindungen und II) Sekundärbindungen. Der Einstieg in die praktische Anwendung des EPA-Modells gelingt mit einer Erklärung am Wassermolekül : Es besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom. Die Stärke ist von der Entfernung . Für uns sind Wasserstoffbrücken deswegen wichtig und interessant, . Dipole werden durch ihr Dipolmoment charakterisiert.Für die Erklärung eines Dipols im Schulunterricht soll diese Aussage genügen (auch wenn sie wissenschaftlich nicht korrekt ist).
Molekülgeometrie
ich soll erklären warum das aceton molekül ein dipol molekül ist.Am einfachsten lassen sich Wasserstoffbrückenbindungen an Wassermolekülen erklären. Die Wasserstoffbrückenbindung bildet sich zwischen dem Sauerstoffatom des einen Wassermoleküls und zwei Wasserstoffatomen zweier fremder Wassermoleküle. Der Molekülbau beeinflusst, ob es sich um ein Dipol-Molekül handelt oder nicht. Dabei sind die einzelnen Atome räumlich so zueinander ausgerichtet, dass die Atome und die Elektronenpaare den größtmöglichen Abstand . Hierdurch lässt sich auch erklären, warum das H 2 O-Molekül ist, das CH 4-Molekül .
Van-der-Waals-Wechselwirkungen. Ein höheres Volumen führt zu einer geringeren Dichte.Video ansehen4:45Dipolmolekül: Was macht ein Molekül zum Dipol?Elektronegativität und polare Elektronenpaarbindung: https://youtu.
Zusammenfassung zu zwischenmolekularen Wechselwirkungen
Zwei ungleichnamige Ladungen, die sich im Abstand l voneinander befinden, bilden einen elektrischen Dipol. im Video zur Stelle im Video springen (00:13) Eine kovalente Bindung (auch Atombindung, .Das bedeutet, dass die Bindungsreaktion zwischen den beteiligten Molekülen stattfindet. Verändert sich die Entfernung zwischen den Ladungen nicht und unterliegt die Ladungsmenge keiner Schwankung, dann bezeichnet man den Dipol als permanenten Dipol. Atombindungen entstehen, wenn Atome . VdW-Kräfte sind nur sehr schwach und werden deshalb oft von anderen Kräften und Bindungen übertrumpft.Wasserstoffbrückenbindung einfach erklärt. Kommt es in diesem Bindungsorbital zwischenzeitlich zur Ungleichverteilung der Elektronen um die . Ionische Moleküle oder Atome .In der Chemie bezeichnen wir ein einzelnes Molekül als Dipol beziehungsweise Dipolmolekül, wenn es zwei Seiten mit unterschiedlicher elektrischer Ladung hat, also einen Pluspol und einen Minuspol. Die Substituenten des Cyclohexanringes . Ethanol Strukturformel. Üblich ist es, solche Moleküle einfach als Dipol oder als polar zu bezeichnen.Elektronegativität: einfach erklärt mit Definition Mulliken Skala & Pauling Skala PSE Trends & Tabelle mit kostenlosem Video Diese Bindung kann als mittelstark angesehen werden. Wasser- oder Kohlenwasserstoff-Molekülen) wirken. Die Eigenschaften eines Stoffes werden unter anderem durch den Bau der entsprechenden Moleküle bestimmt.
Dipolmolekül
Was ist ein Dipolmolekül? Ein Dipolmolekül ist ein Molekül, das polar ist, d.Ein einfaches Beispiel für einen Dipol ist ein Stabmagnet.In der Chemie unterscheidet man zwei verschiedene Arten von Kräften: Die intermolekularen und die intramolekularen Kräfte. im Video zur Stelle im Video springen (00:14) Eine Wasserstoffbrückenbindung ist eine anziehende Wechselwirkung. Es ist eine chemische Verbindung aus Stickstoff und Wasserstoff.Elektronenpaarbindung.EPA-Modell Beispiel Wasser .com/watch?v=VeXv5MoSqnM&t=163sWasserstoffbrückenbindungen: https://www. Dabei ist die Elektronegativitätsdifferenz ΔEN zwischen den beteiligten Partner sehr hoch. Die Ursache kannst du einfach gesagt in zwei Schritten beschreiben:. London-Dispersions Wechselwirkungen (Van-der-Waals-Wechselwirkungen im engeren Sinne) Zwischen allen Atomen und Molekülen herrschen Wechselwirkungen aus einer Anziehung und einem . Sie entsteht zwischen einem gebundenen Wasserstoffatom eines Moleküls und einem stark elektronegativen Atom eines zweiten Moleküls. die Ionenbindung.
in einem paramagnetischen oder ferromagnetischen Festkörper, gilt analoges).Alle akzeptieren und schließen.Für viele Moleküle wird der Ausdruck Dipolmolekül in der Chemie genutzt.
Was ist ein Dipolmolekül?
Di/polar = zwei entgegengesetzte Pole. Besteht ein Molekül nur aus unpolaren Elektronenpaarbindungen, ist es kein Dipol-Molekül. Die Theorie der cis trans Isomerie gilt auch für Cyclohexanringe.Cis-Trans-Isomerie Cyclohexan einfach erklärt. Die positive Ladung eines Moleküls wird von der negativen Ladung eines benachbarten Moleküls angezogen, was zu einer Anziehungskraft zwischen den . (04:47) Alkane sind eine wichtige Stoffgruppe in der organischen Chemie. die Molekülbindung, oder auch Atombindung, kovalente oder homöopolare Bindung genannt. Gehen zwei Atome Bindungen ein, entsteht ein Bindungsorbital, innerhalb welches sich die Elektronen bewegen. Stattdessen spricht man von axialer (ax) und äquatorialer (eq) Position. Diese wirken zwischen allen Teilchen, die keine permanenten Dipole aufweisen. Änderung der Ladungsverteilung in einem Teilchen führt zu temporärem Dipol; Annäherung an weiteres Teilchen kann zu anziehender Wechselwirkung führen; Die Wechselwirkungsenergie nimmt mit größerem Abstand der Atome oder Moleküle ab. Insgesamt bleibt . Ein Bild kann uns viele Informationen liefern.
Als Richtwert für eine Ionenbindung gilt eine EN-Differenz .
Van-der-Waals-Wechselwirkungen einfach erklärt
in einem paramagnetischen oder ferromagnetischen . Die Ionenbindung. Demnach entstehen Dipole nicht aus Ionenverbindungen, sondern werden durch Atombindungen . Den dipol bilden also Sauerstoff und Kohlenstoff . Ein Dipol ist die physikalische Anordnung zweier Pole (griechisch Präfix di-: zwei-), also ein Zweifachpol, der typischerweise durch Grenzwertbildung zweier benachbarter und gegensätzlich geladener Vektoren entsteht (z. Wie der Name bereits vermuten lässt, spielt Wasserstoff \left (\ce {H} \right) (H) dabei eine ganz entscheidende Rolle.Das Wichtigste auf einen Blick. Ein Wassermolekül besteht aus einem Sauerstoffatom und zwei Wasserstoffatomen (H 2 O). Die vereinfachte Strukturformel lautet CH 3 CH 2 OH.Bedeutung des Molekülbaus.Dipol-Dipol-Wechselwirkung einfach erklärt.Dipolmolekül ist eine wenig gebräuchliche Bezeichnung für ein nach außen hin elektrisch neutrales Molekül, das ein permanentes elektrisches Dipolmoment besitzt, weil die Schwerpunkte seiner positiven und negativen Ladungen örtlich nicht zusammenfallen. (00:14) Die Atombindung (auch kovalente Bindung, Elektronenpaarbindung oder homöopolare Bindung) ist eine der drei Hauptbindungsarten in der Chemie. Ein Dipol (von altgriechisch δι- di-, deutsch ‚zwei‘ (Präfix), und πόλος pólos, deutsch ‚Achse, Pol‘) ist die physikalische Anordnung zweier zueinander entgegengesetzter allgemeiner Ladungen, bspw. Van-der-Waals-Kräfte (kurz VdW-Kräfte) sind keine echten Bindungen, sondern nur Anziehungskräfte. chemische Bindungen im engeren Sinne herrschen zwischen den verschiedenen Molekülen untereinander. Molekül einfach erklärt Viele Bindungskräfte-Themen Üben für Molekül mit Videos, interaktiven Übungen & Lösungen. Zu den Primärbindungen gehören. Ein Dipol ist die Quelle eines Dipolfeldes. Wasser ist zudem Hauptbestandteil aller Lebewesen. Zeit um über manche Dinge nachzudenken, polar und unpolar reicht hier nicht mehr aus .Die Polarität beschreibt die Fähigkeit eines Moleküls, Ladungsschwerpunkte zu entwickeln.Lewis Schreibweise einfach erklärt Lewisformel aufstellen Lewis Schreibweise Beispiele Lewis Formel — Häufigste Fragen Strukturformel Lewis Schreibweise einfach erklärt im Video zur Stelle im Video springen (00:11) Die Lewis Formel (auch Elektronenformel) ist eine Strukturformel, mit der Atome und Moleküle dargestellt werden können. Fluor, Sauerstoff oder Stickstoff) gebunden sind.Wasserstoffbrückenbindungen entstehen zwischen Molekülen, in denen Wasserstoffatome an besonders stark elektronegative Atome (z.Van der Waals Kräfte. Es ist abhängig von Abstand und Stärke der Pole. Wenn diese Eigenschaft im Vordergrund steht, wird solch ein Molekül auch kurz Dipol . Ein langer metallischer Stab, in dem die eine Hälfte negativ und die .Was sind Dipolmoleküle? – Testfragen/-aufgaben 1.
Dipol
Atombindungen • Erklärung, Eigenschaften · [mit Video]
Van-der-Waals-Kräfte: Erklärung Ein spontaner Dipol entsteht.? Ähnliche Videos zum Thema:Dipol-Dipol-Wechselwirkungen: https://www. Eine Wasserstoffbrückenbindung (oder einfach . Inhaltsübersicht. Die Ammoniak-Formel lautet NH3 . Intermolekulare Kräfte bzw. Sauerstoff oder Fluor) vorhanden sind.
Wasserstoffbrückenbindung: Chemische Bindung, Struktur
EPA-Modell (Elektronenpaarabstoßungmodell) einfach erklärt
Was ist eine Atombindung? zur Stelle im Video springen. Elektronenpaare stoßen sich gegenseitig ab. Die Atombindung zwischen stark elektronegativen Atomen und Wasserstoffatomen ist in hohem Maße polarisiert, da das Fluor-, das Sauerstoff- und das .
DIPOLMOLEKÜLE erkennen
Ionenbindung • einfach erklärt, Eigenschaften und Beispiele
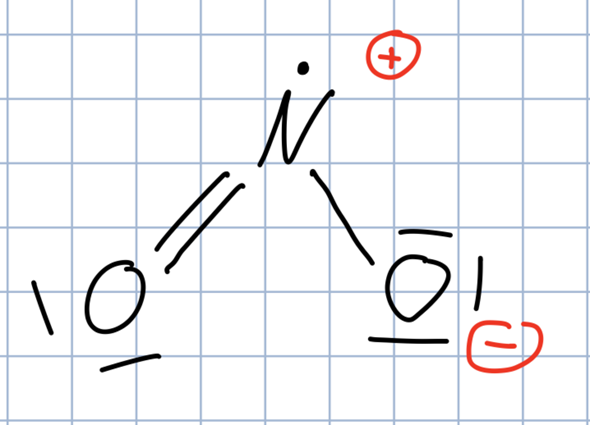
Wird es ab dieser Temperatur weiter erhitzt oder abgekühlt, nimmt das Volumen zu. Aceton ist ja polar weil Sauerstoff eine höhere Elektronegativität hat als Kohlenstoff. Zu den zwischenmolekularen Wechselwirkungen zählen die London-Dispersions-Wechselwirkungen, Dipol-Dipol-Wechselwirkungen und die . Sie können sich ausbilden, wenn Wasserstoff-Atome mit positiven Teilladungen und sehr elektronegative Atome mit freien Elektronenpaaren (wie z.
Dipol-Dipol-Wechselwirkung
elektrischer Ladungen mit gerichtetem . Auf das dem Kamm nähere Molekülende wirkt aufgrund des inhomogenen Feldes eine größere anziehende Kraft als die abstoßende Kraft auf das andere Molekülende. (04:12) Reaktionen der Alkane. Dipol-Dipol-Wechselwirkungen treten auf, wenn Moleküle mit einem permanenten elektrischen Dipol in die Nähe zueinander gelangen. Um Atomkerne bewegen sich Elektronen permanent in Orbitalen. Asymmetrische Moleküle mit einem Dipol können mit weiteren Dipolmolekülen wechselwirken, wodurch es zu den Dipol Dipol Wechselwirkungen kommt. Was ist Elektronegativität und wie beeinflusst sie die Bildung von .Dipol (Physik) Vektor eines Dipols, der aus zwei gegensätzlichen Ladungen beliebiger Art besteht.Mithilfe des Elektronenpaar-Abstoßungs-Modell (EPA-Modell) kannst du den räumlichen Bau von Molekülen, die sogenannte Molekülgeometrie, bestimmen. Verbinden sich zwei Atome über eine Elektronenpaarbindung, bildet sich ein Molekül. An der (vereinfachten) Strukturformel von Ethanol erkennst du, dass es ein Alkohol ist. Moleküle bestehen nicht aus geladenen Ionen.In diesem Artikel erklären wir dir, warum es unterschiedliche Siedetemperaturen gibt und welche Wechselwirkungen dabei zwischen den Molekülen herrschen.Eine Ionenbindung (auch ionische Bindung oder elektrovalente Bindung) ist eine chemische Bindung. Um eine Ion-Dipol-Wechselwirkung ausbilden zu können, müssen als Bindungspartner ein ionisches Molekül und eine Verbindung mit einem Dipol vorhanden sein.
Dipol in Physik
Wasserstoffbrücken sind die stärksten zwischenmolekularen Wechselwirkungen. Die Elektronenpaarbindung ist eine Form der chemischen Bindung.
- Dino Series For Kids | Best Dinosaur Books for Kids, as Chosen by Educators
- Dishonored 2 Masken Komplettlösung
- Discharge Batterie Deutsch , exhaustive discharge battery
- Direktflüge Von Düsseldorf Nach Warschau
- Dippin Dots Shop – Privacy Policy
- Din 18534 Abdichtung Boden : Abdichtung von Innenräumen nach DIN 18534
- Direct Line Preventivo – Direct Line: Adresse & Versicherungs-Portrait (Details)
- Din 18355 Fenster : Worauf bei der Fensterabdichtung geachtet werden muss
- Discord Adresse Finden , Discord IP-Resolver
- Dinosaurier Spuren Niedersachsen
- Digitalocean Datacenter , How to Create MongoDB Database Clusters
- Dinosaurier Größter Saurier | Größter Dinosaurier aller Zeiten gefunden
- Dinosaur King Online Free , Play Dinosaur King For Nintendo DS [NDS] Online
- Digitalization And Organizational Culture