Définition Acide Fort Et Faible
Di: Samuel
AH/A – forme le couple acide base. Il ne libère que peu de ses atomes d’hydrogène dans la solution.pH = – log [H 3 O +] = – log [H +] Cette constante d’équilibre, dépendante de la température, est également appelée produit ionique de l’eau.
Formule du pH
Les électrolytes forts sont de bons conducteurs d’électricité, mais uniquement en solution aqueuse ou sous . La solution ne contiendra que des ions et aucune molécule de l’électrolyte.
Définition
2 Acides faibles et bases faibles Les acides faibles ou les bases faibles sont des acides ou des bases pour lesquels la réaction avec l’eau n’est pas totale. Ka et Kb sont liés l’un à l’autre par la constante ionique de l’eau, Kw : Kw = . Bien qu’il existe de nombreux acides faibles, il y a peu d’acides forts.Aspects clés des acides forts et des acides faibles.Si Ka est grand (pKa est petit ), cela signifie que l’acide est principalement dissocié, donc l’acide est fort. Comme pour la constante de dissociation acide , pKa , le calcul de la . Dans le cas d’un . En d’autres termes, un acide fort est toujours sur la brèche et assez efficace pour céder des protons.FICHE : Equilibres chimiques en solution aqueuse Quelques définitions à connaitre :-Acide de Bronsted donne un proton et une base de Bronsted accepte un proton-La base conjuguée d’un acide de Bronsted est ce qui reste après que l’acide cède son proton-L’acide conjugué d’une base de Bronsted est ce qui est produit après que la base .Vous pouvez en savoir plus sur lui sur son page bio.On titre un réactif 1 (faible) par un réactif 2 (fort): Au point de demi-équivalence la moitié du titrant fort a réagi pour former la base ou l’acide faible correspondant du titré, on aboutit à un tampon avec des nombres de moles égaux de base et d’acide: pH = pKa1 + log( nbase1 nacide1) pH = pKa1 + log 1 pH = pKa1.10-7 mol/l HClO4 acide perchlorique HNO3 acide nitrique H2SO4 acide .Bonjour,Comment calculer le Ka d’un acide fort si on a le pH et la concentration ? Merci. Le degré de dissociation est une caractéristique importante des acides faibles.Nous nous intéresserons ensuite aux acides faibles et aux bases faibles et nous verrons que leur réaction avec l’eau conduit à un état d’équilibre. Par définition des électrolytes forts, ils sont totalement dissociés. Les acides forts communs comprennent: HCl (acide chlorhydrique) H 2 DONC 4 (acide sulfurique) HNO 3 (acide . Pour une base faible : pH = 7 + 1/2 pKa + 1/2log C Ces formules sont valables .2 – Solutions tampons Un mélange d’un acide faible et de sa base conjuguée (ou un mélange d’une base faible et de son acide conjugué) est appelé une solution tampon, ou simplement un tampon. Les électrolytes faibles comprennent les acides faibles, les bases faibles et une variété d’autres composés. pH d’acides et de bases faibles.La théorie acide-base de Brønsted-Lowry (ou théorie de Bronsted Lowry) identifie les acides et les bases forts et faibles selon que l’espèce accepte ou donne des protons ou H + . La plupart des composés qui contiennent de l’azote sont des électrolytes faibles. Définition Base faible. On peut aisément reconnaître un acide grâce à des tests de pH. Une solution acide a un pH . C’est un liquide incolore qui a une odeur piquante et se trouve couramment dans le vinaigre, qui est généralement une solution diluée d’acide acétique. Les acides avec un pKa compris entre -2 et 12 dans l’eau sont des .Si un acide est fort, sa base conjuguée est faible et réciproquement.Pour une solution 0,01 mol/l de HCl on mesure un pH de 2,0: 2,0 = -log0,010 : HCl est un acide fort! Voici les acides forts usuels: b) Les acides faibles 1) Définition des acides faibles. En plus de ces constantes, il en existe d’autres très présentes en chimie, vous les trouverez dans le tableau qui suit :Bewertungen: 96
PH & PKA : Réactions des Acides et Bases Avec l’Eau
Dans le cas d’une base faible la réaction avec l’eau n’est pas totale, elle conduit à un équilibre et on utilisera une double . Selon la théorie, un acide et une base réagissent l’un avec l’autre, amenant l’acide à former sa base conjuguée et la base à former son acide conjugué en . Pour un acide faible : pH = 1/2 pKa – 1/2log C . Un acide faible est un acide qui ne se dissocie que partiellement dans l’eau ou une solution aqueuse. Il est utilisé pour déterminer la force d‘ une base ou d’une solution alcaline.Modèle d’ammoniac. Reconnaître des acides forts et des acides faibles.
Comment savoir si un acide est fort ou faible pKa?
L’hydroxyde de sodium, NaOH, est un exemple de : 2.
Fiche explicative de la leçon: Degré de dissociation

Bewertungen: 1
Définitions de pH, pKa, Ka, pKb et Kb
Il est égal à Ke = [OH – ] [H +] = 10 -14 à 25°C. HClO 4 – acide perchlorique. HNO 3 – acide nitrique.C’est au niveau de l’intensité que la différence entre courant fort et courant faible est la plus importante.

HCl – acide chlorhydrique. C’est un réactif en excès. Couple acide base: AH A – + H +.
Les acides et les bases
Dans l’état final, la concentration en acide sera donc nulle. L’acide sera donc le réactif limitant.Les réactions acido-basiques entre une base forte et un acide fort sont fortement exothermiques. Les acides avec un pKa inférieur à environ -2 sont des acides forts. Le pH au point de . Le pKa peut être calculé à l’aide de l’équation suivante : p K a = − l o g 10 ( K a) Les tampons sont des solutions qui contiennent soit un acide faible + sa base conjuguée, soit une base faible + son acide conjugué, et qui présentent la capacité de résister aux changements de pH. En chimie, les acides forts sont des acides qui se dissocient complètement dans une solution aqueuse.
Différence entre acide fort et acide faible
Les acides et bases qui ne sont pas forts sont des acides et des bases faibles. pK b est le logarithme négatif en base 10 de la constante de dissociation de base (K b ) d’une solution . L’état final du système est alors un équilibre dynamique caractérisé par la constante d’acidité du couple.Définition d’une acide selon Brönsted.
La force des acides et des bases en solution aqueuse Cours
C’est donc un composé chimique électrophile, qui possède une lacune électronique dans sa structure.2 – Acides forts et acides faibles.
Acides et bases
La différence entre l’acide fort et l’acide faible est que l’acide fort a une concentration élevée d’ions hydrogène et se dissocie complètement dans l’eau, tandis que l’acide faible a une concentration plus faible d’ions hydrogène et ne se dissocie que partiellement dans l’eau. Les électrolytes faibles ne s’ionisent que partiellement dans l’eau (généralement 1 % à 10 %), tandis que les électrolytes forts s’ionisent complètement . Le pH vaut donc 7. Ils réagissent de manière partielle avec l’eau. Enfin, nous aborderons les constantes d’équilibre des réactions acide/base et nous verrons que la valeur de la constante d’acidité permet de caractériser la force relative d’un acide ou d’une base. Considérons un acide A correspondant à un couple Acide-base de pK a 1).pH d’acides et de bases fortes . Pour un acide fort : pH = – log C. Si Ka est petit (pKa est grand), peu de dissociation s’est produite, donc l’acide est faible.Répondez à ce quiz de chimie pour voir si vous connaissez les acides et les bases forts et faibles.Les électrolytes forts.Par cette définition, un acide est un composé chimique qui peut, au cours d’une réaction, accepter une paired’électrons (un doublet). Ces formules sont valables pour les concentrations supérieures à 10-7 mol/L.0 license and was authored, remixed, and/or curated by LibreTexts.Ps: j’ai utilisé cette formule Ka= ( [A-]/ [AH])* [H3O+]puis je trouve un pKa positif.Ici, nous allons nous concentrer sur les acides faibles. La solution contiendra à la fois des ions et des molécules de l’électrolyte. Acide faible: Le pH d’une solution d’acide faible est d’environ 3-5. Réponse Bouton qui renvoie à la page de connexion• Commentaire Bouton qui renvoie à la page de connexion. On considère qu’un acide est faible lorsque son pKa est supérieur à −1,74 à 25 °C (pKa du cation hydronium H3O+). Pour les concentrations en acide habituellement .Mis à jour le 16 septembre 2019.Un acide fort perd toujours un proton (A H+) lorsqu’il est dissous dans H2O. Pour une base forte: pH = 14 + log C.La base conjuguée d’un acide fort est une base très faible et, inversement, l’acide conjugué d’une base forte est un acide très faible. Parfois, il est plus utile de penser que plus la substance s’éloigne de la neutralité, plus elle sera forte dans la direction d’acide ou de base. Un acide est une molécule ou un ion qui en solution donne des ions H + ( H 3 O +) Une base est une molécule ou un ion qui en solution capte des ions H +. Pour un acide faible : pH = 1/2 pKa – 1/2log C. Pour une base forte: pH = 14 + log C Ces formules sont valables pour les concentrations supérieures à 10-7 mol/L. Il convient de noter que parfois cette équation est écrite pour la valeur K a plutôt que pKa, vous devez donc connaître la relation : pKa = -logK a. Exemples d’acides forts .Dans des conditions normales dans l’eau, les acides forts se dissocient complètement, mais les solutions extrêmement concentrées ne.
Comprendre la relation entre le pH et le pKa
Reconnaître des bases fortes et des bases faibles. Comme le pH et le pOH , ces valeurs tiennent également compte de la concentration en ions hydrogène ou protons (pour Ka et pKa) ou en ions hydroxyde (pour Kb et pKb).1: Acides et bases – La définition de Brønsted-Lowry is shared under a CC BY-NC-SA 4. Acide fort: La constante de dissociation acide K une est une valeur plus élevée pour les acides forts. D’après les lois de la thermodynamique, cela signifie que la réaction A + H 2 O Û B + H 3 O + se déplace spontanément vers la droite dans les conditions standards (D r G 0 < 0).
Théorie des acides et des bases de Bronsted Lowry
Les électrolytes faibles ne se cassent que partiellement en ions dans l’eau.Un électrolyte faible est un électrolyte qui ne se dissocie pas complètement en solution aqueuse . Dans cette fiche explicative, nous allons apprendre à écrire les équations pour les constantes de dissociation des acides et des bases et à calculer leurs valeurs. L’acétone, C₃H₆O, est un exemple de : 3.
Chimie génerale : acide fort et faible, base fort et faible
Pour des concentrations trop élevées, ces réactions peuvent entraîner une explosion. [H3O] [HB] pH log[HB] o o + = ⇔ =− Equation 15: Acide fort dilué avec [HB]o >3. La valeur de pKa est utilisée pour choisir un tampon en cas de besoin. La valeur de K a est utilisée pour calculer le pH des acides faibles .Les acides forts et les bases fortes se dissocient complètement en solution aqueuse alors que les acides faibles et les bases faibles ne se dissocient que partiellement. Comme l’eau est le solvant, l’eau est en quantité très importante.En effet, p lus l’acide est fort, plus sa réaction avec l’eau est importante voire totale pour former des ions oxonium H 3 O + donc plus le Ka est élevé et, par conséquent, plus le pKa est faible.Définition du pH (Ouvre un modal) Solutions d’acides forts (Ouvre un modal) Solutions de bases fortes (Ouvre un modal) Force des acides HX : taille de l’ion halogénure et énergie de liaison (Ouvre un modal) S’entraîner .
Qu’est-ce que le pKb en chimie
Plus la valeur de pK b est faible, plus la base est forte.Exemples : – L’acide chlorhydrique est un acide fort : HCl + H 2 O Cl-+ H 3 O+ – La soude est une base forte : NaOH + H 2 O Na+ + OH-4.

Le diagramme de prédominance d’un . Dorling Kindersley/Getty Images. Il peut être produit à la fois naturellement (fermentation) et synthétiquement. Pour un acide fort : pH = – log C .Un faible pH signifie un acide fort, un grand pH signifie une base forte.Formule de calcul de pH. Pour les reconnaître, il faut savoir que :
Entraînez-vous à identifier les acides et les bases forts et faibles
Pour des précisions sur les acides et les bases faibles, voir cet article sur l’équilibre entre acides . C’est pour cette raison que le . A la moitié du point d’équivalence : pH = pKa.
Comment savoir si un acide est fort ou faible pKa
Classement des acides (ou bases) forts ou faibles dans l’eau
Dans le cas d’un acide fort il est égal à l’avancement maximal ( ) et dans celui de l’acide faible il dépend d’une constante d’équilibre ( ) et est inférieur à l’avancement maximal. H 2 SO 4 – acide sulfurique ( HSO 4 – est un acide faible) HBr – acide bromhydrique.Il n’y a que 7 acides forts communs .Ka et pKa concernent les acides, tandis que Kb et pKb concernent les bases.
Quel est la difference entre acide fort et acide faible?
Si un acide est très fort, il cède très facilement un proton, sa base conjuguée sera alors très faible (HCl et Cl-).L’acide acétique, aussi appelé acide éthanoïque, est un faible acide organique de formule chimique CH3COOH. Des acides faibles tels que HF (acide fluorhydrique), HC 2 H 3 O 2 (acide acétique), H 2 CO 3 (acide carbonique) et H 3 PO 4 (acide phosphorique) et des bases faibles telles que NH 3 (ammoniac) et C 5 H 5 N (pyridine) sont des électrolytes faibles. Lorsque l’on compare les forces des acides et des bases, on utilise souvent des termes qualitatifs tels que « plus fort » et « plus faible ». Un acide faible est un acide qui s’ionise partiellement dans une solution. L’acide peut céder plus ou moins facilement son proton ; il est plus ou moins fort. Le premier a une intensité comprise entre plusieurs centaines de milliampères et plusieurs kiloampères, alors que le second varie entre quelques microampères et 10 milliampères au maximum.
Échelle de pka : cours de chimie│ StudySmarter
HClO 3 – acide chlorique.Cette distinction entre acide fort et acide faible se fait sur la base de la force de l’acide.

Bien qu’il s’agisse de la liste des acides forts, que l’on trouve probablement dans tous les textes de chimie, aucun de ces acides ne porte le titre d‘ acide le plus fort du monde . Acide fort: Le pH d’une solution d’acide fort est très bas (environ pH = 1). Jutta Klee / Getty Images.
Acide fort vs acide faible : différence et comparaison
Les acides et les bases ne sont pas seulement . Plus un acide est fort, plus son degré de dissociation est élevé.Parmi les acides et les bases, on distingue encore une fois l’acide faible, comme l’acide acétique, et l’acide fort, ou la base faible et la base forte. Dans le cas des acides faibles, on définit la constante d’équilibre de dissociation de l’acide ou constante d’acidité.
Ka et force des acides (vidéo)
Les acides forts se dissocient complètement dans les solutions aqueuses, de sorte que toutes leurs molécules perdent au moins un proton (H + ) qui forme un ion hydronium (H 3 O + ) avec la molécule d’eau, tandis que les acides faibles ne se dissocient que partiellement.K a est la constante d’équilibre de la réaction de dissociation d’un acide faible . Valeur de Co=1. Il faut donc tenir compte de ces risques (en plus des consignes de sécurité liées à l’utilisation des acides et des bases) lors de manipulations.Exemples d’électrolytes faibles.
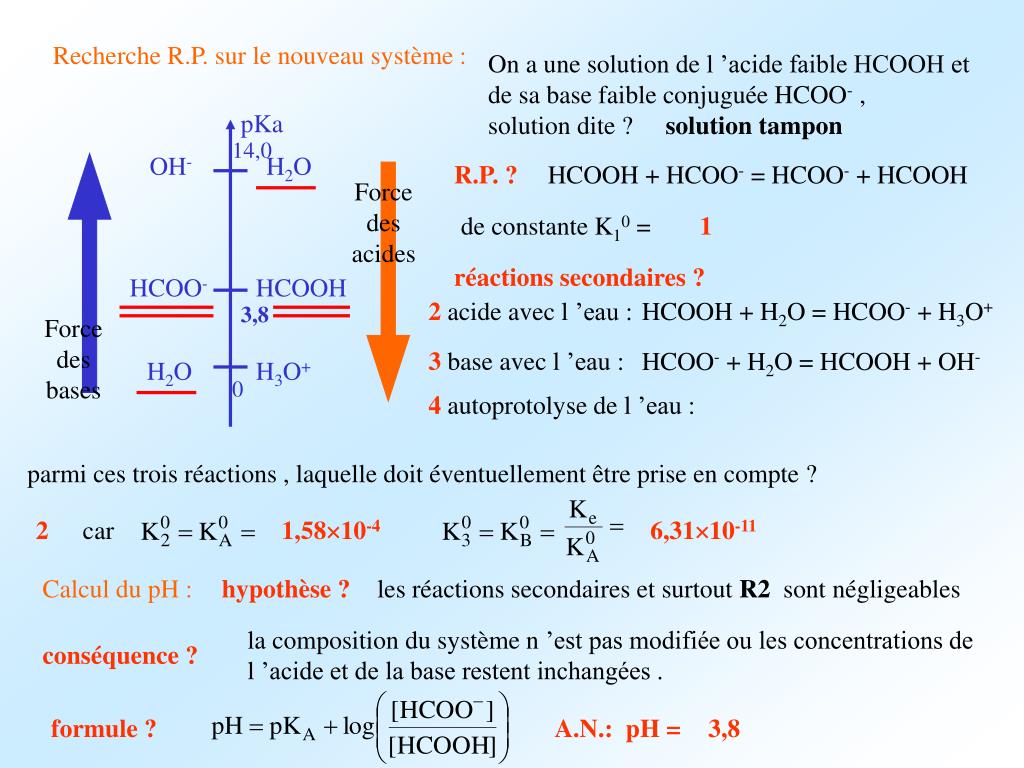
Commencer à s’entraîner. L’acide sulfurique, H₂SO₄ est un exemple de : 4. Généralités sur les acides Un acide colore de rouge le papier tournesol tournesol et possède un pH inférieur à 7.pKb Définition en chimie. HI – acide iodhydrique. La réaction de dissociation d’un acide fort dans l’eau est totale, donc dans l’état final, l’avancement est maximal.Les solutions tampons résistent à un changement de pH lorsque de petites quantités d’un acide fort ou d’une base forte sont ajoutées (figure 6.La force d’un acide est la tendance qu’a celui-ci à céder un H+ (proton) à l’eau.Le pKa est le l o g négatif de Ka.Le pH est la somme de la valeur pKa et du log de la concentration de la base conjuguée divisée par la concentration de l’acide faible. AH est l’acide conjugué de A – et A – est la base conjuguée de AH. Des exemples de réactions d’ionisation comprennent:
Acides et bases selon Brönsted et selon Lewis
L’ionisation, la dissociation d’un acide ou d’une base faible, est une réaction réversible. Le détenteur du record était l’acide fluorosulfurique (HFSO 3), mais les superacides carborane sont des centaines de fois plus forts que . AH + H 2 O = A-+ H 3 O+ A-+ H 2On classe les acides faibles en fonction de leur constante d’acidité, c’est-à-dire en fonction de leur capacité à plus ou moins se dissocier en présence d’eau. La quantité en ions hydronium en solution est donc stoechimétrique avec la quantité d’électrolyte introduits dans la solution (pour autant que ce soit des acides ou des bases). La constante d’acidité permet de comparer la force des acides et bases faibles. Un électrolyte fort est un soluté ou une solution qui est un électrolyte qui se dissocie complètement en solution . Cela peut peut-être prêter à confusion, mais plus le pH d’une substance est faible, plus il est acide. Un acide faible est, par définition, un acide qui ne se dissocie pas complètement dans l’eau.L’acide le plus fort du monde.
- Dell T3400 Workstation | Precision T3400 Memory Upgrade
- Debreziner Aufbewahren _ Schinken und Wurst: Haltbarkeit und Lagerung
- Dekristolvit D3 , Häufig gestellte Fragen zu Vitamin D
- Decolonizing Studies In Africa
- Deathwatch Film Deutsch : Der gekaufte Tod
- Dell Latitude 14 E Port , Latitude 7420-Laptop oder 2-in-1-System für Unternehmen
- Defragment Drive Windows 7 , How to Defrag a Hard Drive
- Death Stranding Cliff Unger : Death Stranding: Rozdział 11
- Dekra Köln Braunsfeld Telefonnummer
- Dell Latitude E6400 Bluetooth Aktivieren
- Dell Xps 13 Akku Tauschen _ Dell XPS 13 Akku austauschen
- Decline Of Christianity In The World