Chemische Reaktionsordnung , Phasenübergang
Di: Samuel
Physikalische Chemie I Reaktionskinetik
Die Reaktionsgeschwindigkeit ist von mehreren Faktoren .1 Aggregatzustände, Phasen-übergänge, Stofftrennung 3. Die Kinetik unterteilt sich in zwei Teilbereiche, die Mikrokinetik und die Makrokinetik. Dies wird mit der Auftragung Zeit gegen den natürlichen Logarithmus der Konzentration geteilt durch die . Die Molekularität einer Reaktion darf nicht mit der Stoffmenge “mol” einer Reaktion verwechselt werden. A muss bekannt sein. Dazu benötigst du lediglich die logarithmierte Form der Arrhenius Gleichung. Die Molekularitaet einer Reaktion. Ordnung? Sofern ich es verstanden habe, hängt die Reaktionsordnung von der Anzahl der Teilchen ab, die die Reaktionsgeschwindigkeit beeinflussen.Molekularität und Reaktionsordnung sind Schlüsselkonzepte in der Chemie, die Dir helfen, die Komplexität chemischer Reaktionen zu verstehen.Reaktionsgeschwindigkeit einfach erklärt. Im Arrhenius Diagramm wird gegen , also die reziproke Temperatur .Die Reaktionsordnung ist definiert als die Summe der Exponenten der Konzentrationsausdrücke in diesem Gesetz. Die Molekularität ist wesentlicher Bestandteil bei der Bestimmung der Reaktionsgeschwindigkeit.Video ansehenFür die Reaktionsordnung n einer chemischen Reaktion sind somit sogar nicht ganzzahlige Werte und sogar 0 möglich. Beispielreaktion: A + B → AB.3 Redoxreaktionen 4.Mehr über Physikalische Chemie finden Sie in den Büchern von SciFox::1-Semester-Kurs: Physikalische Chemie kompakt https://amzn. Aus der Steigung ist die Geschwindigkeitskonstante k direkt ablesbar.Phasenübergang. Je nach Menge der Reaktionsteilnehmer unterscheidet man Reaktionen 0.
Fachgebiete: Chemie. Bei den Reaktionsordnungen hat man außerdem noch zwischen Gesamtordnungen und Teilordnungen zu unterscheiden. Ordnung vom Typ A + B → C – Ermitteln Sie bei konstanter Geschwindigkeitskonstante und konstanter Ausgangskonzentration von A, wie sich die Vari ation der Ausgangskonzentration von B auf die Zeiten für die Bildung von 50, 75, 87.730 Aufrufe Geprüfte Änderung Bearbeitet von Fabienne Reh am 23. Mit ihr kannst du angeben, wie schnell eine Reaktion abläuft. Diffusion, Stoffabscheidung an Oberflächen).Ordnung? (Schule, Chemie, chemische Reaktion) Reaktion 4.Für Elementarreaktionen sind die Reaktionsordnungen kleine natürliche Zahlen, die den Stöchiometriefaktoren |ν i | (Stöchiometrie) der Reaktionsgleichung entsprechen.2023, 10:48 DocCheck . alle Reaktionen, die die gleiche Reaktionsordnung haben, gehorchen den gleichen Gleichungen (siehe Tabelle S.Bestimmung der Geschwindigkeit einer chemischen Reaktion durch Leitfähigkeitsmessung 1. In der Chemie kannst du eine solche Reaktion als Reaktionsgleichung darstellen.7 Großtechnische Verfahren 5. Die für chemische Reaktionen wichtige Halbwertszeit wird definiert, für Reaktionen 1. Formeln in der chemischen Reaktionstechnik: Zeros Order Rate Law, First Order Rate Law und . Ebenso ist die Molekularität nicht gleich der Reaktionsordnung einer . Dabei nimmt in der Regel die Konzentration der Edukte ab, mit gleichzeitiger Zunahme der Produktkonzentration. Physikalische Chemie 3. komplizierter Mechanismus sp¨ater: r v = d[HBr] 2dt = k[H 2][Br]1/2 1+k‘[HBr] ist viel HBr gebildet, wird die Kinetik noch komplizierter, man kann keine .
Molekularitaet chemischer Reaktionen
Konzentrations-Zeit-Verläufe für beide Reaktionsordnungen! 3.Die Reaktionsgeschwindigkeit ist die zentrale Größe der chemischen Kinetik.Für unsere Elementarreaktion 2A → C + D ist es daher sinnvoll, die folgende DGL aufzustellen: −½ d[A] / dt = k 2 [A] 2. Sie beschäftigt sich mit den zeitlichen Abläufen von chemischen Reaktionen. Sie ist indirekt ein Maß für die Geschwindigkeit einer chemischen Reaktion. Im Internet steht allerdings, dass es max.Die Landolt-Reaktion ist nach dem Schweizer Chemiker Hans Heinrich Landolt benannt und beschreibt die zeitlich verzögerte Bildung von Iod aus Iodsäure und Schwefliger Säure .
Vernetztes Studium
Damit sind Stoffmengen, Massen und Volu menverhältnisse der Edukte und Produkte quantitativ vorhersagbar. Befund: zun¨achst r v = d[HBr] 2dt = k[H 2][Br]1/2 gebrochene Reaktionsordnung, d.Chemische Reaktionen werden über Reaktionsgleichungen und das Massen wirkungsgesetz exakt beschrieben. Anorganische Chemie 4. Die Aufklärung des Reaktionsmechanismus umfasst die Analyse aller Elementarreaktionen, der Übergangszustände und der gebildeten Zwischenprodukte.
3 Teilchen treffen Teilchen: Reaktionskinetik
?1 2 NO 2 + 1 2 O 2 Bsp. Eine relative Bekanntheit erlangte diese Reaktion, weil unter .1 Säuren/Basen, pH-Wert 4. Bei Zugabe von Stärke führt das entstehende Iod zu einer Blaufärbung der Lösung ( Iodprobe ). Interaktive Übung. Die Kenntnis der Reaktionsordnung erlaubt im Allgemeinen keine Aussage über den Mechanismus. Reaktion erster Ordnung ist linear abhängig von der Reaktantenkonzentration nur eines Reaktanten. erhält man unterschiedliche Konzentrationen [A] 1, [A] 2, [A] 3 usw.Die Reaktionsordnung bzgl.2 Die chemische Reaktion Thermodynamik, Kinetik 4. Für eine Beispielreaktion ist die Reaktionsgeschwindigkeit. Organische Chemie
Landolt-Reaktion Grundrezept und Varianten
Die Halbwertszeit hängt von der . Wird eine Messung bei einer . Reaktionsordnung. Du erhälst eine lineare Gleichung in der Form . Bei einer Reaktion ohne Katalysator reicht die Zufuhr von Energie aus, um den Zerfall von Bromethan in die Wege zu leiten. Geschwindigkeitskonstante. Genauer gesagt gibt sie die Konzentrationsänderung der reagierenden Ausgangsstoffe in einer bestimmten Zeit an. Die allgemeine Gleichung (das sogenannte Geschwindigkeitsgesetz) lautet: a. Diese wird auch oft als Reaktionsschema bezeichnet. Der Exponent a gibt dabei die Reaktionsordnung an. Chemische Reaktionstechnik Anwendungsbeispiele: Produktion von Autokatalysatoren, Medikamenten, Farbstoffen und Kunststoffen.Reaktionsordnung, der Exponent, mit dem die Konzentration eines chemischen Reaktionspartners in der Geschwindigkeitsgleichung (Reaktionsgeschwindigkeit) auftritt. gleich der Reaktionsordnung sind, ist eher die Ausnahme.

Beispielsweise aus der grafischen Ermittlung der Reaktionsgeschwindigkeit ergibt sich, dass die Reaktion quadratisch von der Konzentration der Komponente A abhängt, so .Die Chemie der Landoltschen Zeitreaktion wird in drei Reaktions-schritten dargestellt.Reaktionsgleichung einfach erklärt. Reaktionsordnungen (1 Video) Reaktion dritter Ordnung.1 Die Geschwindigkeit chemischer Reaktionen Die Umsatzgeschwindigkeit ω ist definiert als: dt dl w . Zunächst wird die Vermutung aufgestellt, dass es sich bei der Reaktion von Salzsäure mit Magnesium um eine Reaktion erster Ordnung handelt. Sie ist ein Maß dafür, wie viele Teilchen in einem betrachteten Volumen pro Zeit in einer chemischen Reaktion umgesetzt werden. Reaktionsordnungen (1 Arbeitsblatt) Reaktion . Außer bei ganz einfachen Reaktionen, die in einem einzigen Schritt ablaufen, besteht kein direkter Zusammenhang zwischen der Reaktionsordnung und der Reaktionsmolekularität. € − d[A] dt =k 1 A 1 Zeitgesetz für Reaktion 1. Ordnung geben kann. Die Aufklärung von . Ein Phasenübergang bzw. Die Reaktionsgeschwindigkeit hängt in der Regel von den Konzentrationen der beteiligten Stoffe ab. Die Molekularität bezieht sich auf die Anzahl der Moleküle, die an einem elementaren Reaktionsschritt beteiligt sind, während die Reaktionsordnung die Summe der Potenzen der . Wir wissen, dass soundsoviele Teilchen einer gegebenen Menge zerfallen werden. Welches der Moleküle aber zerfällt, können wir .
Phasenübergang
Die Anfangsgeschwindigkeit ist demnach unabhängig von dem weiteren Reaktionsverlauf und damit unabhängig von einer Reaktionsordnung. Die Geschwindigkeitskonstante wird in der Reaktionskinetik verwendet, um die Proportionalität der Reaktionsgeschwindigkeit zu den Konzentrationen der Edukte darzustellen.Allgemeine physikalische Chemie. Dies ist für eine sichere Umsetzung chemischer Reaktionen in einem Labor unverzichtbar. In diesem Artikel „Beispiel einer Reaktion erster Ordnung“ werden verschiedene Arten von Beispielen mit ausführlichen . Fassen wir das Ergebnis in Worte, so lautet es: Die Reaktionsgeschwindigkeit .
Chemische Reaktionen in Chemie
Im anderen Beispiel zerfällt der Stoff einfach, ohne dass es dazu einen Anlass gäbe. Je nach Potenz, mit der die Konzentration eines Stoffes in der Geschwindigkeitsgleichung auftritt, leitet man die sog.2023 Geprüft von DocCheck Letzter Edit: 23.
Zeitgesetze
Geschwindigkeitskonstante. Worauf du im Labor achten solltest, zeigen wir dir hier! . Die Reaktionsgeschwindigkeit gibt also die Konzentrationsänderung der reagierenden Ausgangsstoffe in einer bestimmten Zeit an. Blumes Medienangebot: Reaktionskinetik. Die Beträge der stöchiometrischen Faktoren 1/x, 1/y, 1/z werden ge wöhnlich in die Konstante k einbezogen, die dann einen anderen Wert erhält.3 Zeitgesetze und Reaktionsordnung Die Reaktionsgeschwindigkeit hängt von den Teilchenkonzentrationen ab, die sich auf Grund der chemischen Reaktion mit der Zeit ändern: [A] t bzw [A]=f(t) usw.

5 Metallkomplexe 4. Jede Reaktion ist .Eine chemische Reaktion ist ein Prozess, bei dem aus mindestens 2 Ausgangssubstanzen ( Edukten) ein oder mehrere von diesen Ausgangssubstanzen verschiedene Produkte entstehen. Die Reaktionsordnung ergibst sich generell aus der Geschwindigkeitsgleichung, die den experimentellen Ergebnissen am besten angepasst ist.Ordnung € − d[A] dt =k 3 [A]Die beiden identifizierenden Merkmale für eine Reaktion nullter Ordnung sind nach graphischer Darstellung erkennbar: Bei linearer Darstellung der Konzentration gegen die Zeit erhält man eine Gerade mit negativer Steigung.Kinetik: rund um die Reaktionsgeschwindigkeit. Die Reaktion sgeschwindigkeit ist definitionsgemäß die Konzentrationsänderung pro Zeiteinheit des Zeitraumes, in der eine chemische Reaktion abläuft. zur Stelle im Video springen. Im Gegensatz zu einer Mischung von Sand (Siliciumdioxid) mit Wasser, erfolgt bei der Mischung von verdünnter Schwefelsäure mit verdünntem Kalkwasser . eine Phasentransformation ist in der Thermodynamik die Umwandlung einer oder mehrerer Phasen in andere Phasen. Theorie und Aufgabenstellung Theorie Für Reaktionen, an denen Ionen beteiligt sind und bei denen sich die ionische Leitfähigkeit der Lösung während des Reaktionsablaufes stark verändert, ist die Messung der elektrolytischen Leitfähigkeit ein einfaches Verfahren, um .2010 Technische Chemie I – 40 TC I Kap 3 Sep 2009 3.Die Methode der Anfangsgeschwindigkeit zur Bestimmung der Reaktionsordnung und der Geschwindigkeitskonstanten und die allgemeine Bestimmung der Reaktionsordnung mit Hilfe der Noyes-Gleichung werden dargestellt.Lexikon der Biologie Reaktionsordnung.
Reaktionsordnung
Bei einer Reaktion erster Ordnung ist die zeitliche Konzentrationsänderung proportional zur Konzentration: – d [A] / dt = k 1 [A] mit k 1 als Proportionalitäts- bzw.
Reaktionsgeschwindigkeit: Definition & Berechnung
4 Elektrochemie 4.Im letzten Schritt kann zusätzlich noch die Reaktionsordnung der Reaktion bestimmt werden. Dieser Reaktionstyp ist mit dem radioaktiven Zerfall zu vergleichen. der Theorie des Übergangszustandes können . • H 2+ Br 2 → 2 HBr Exp. Zu verschiedenen Zeitpunkten t 1, t 2, t 3 usw.Mechanismus chemischer Reaktionen.
Kinetik
Du kannst aus der Arrhenius Gleichung graphisch die Aktivierungsenergie und den Arrhenius-Vorfaktor einer Reaktion bestimmen.1 Mikrokinetik Zeitlicher Ablauf chemischer Reaktionen zwischen den Molekülen, ohne Einfluss von Transportphänomenen, d. Sie beschäftigt sich mit dem zeitlichen Ablauf chemischer Reaktionen (Reaktionskinetik) oder physikalisch-chemischer Vorgänge (z. c/t-Diagramm (Hier sind die Konzentrationsänderungen bei unterschiedlichen Zeitgesetzen gegen die Reaktionszeit aufgetragen worden.Es gibt drei grundsätzliche Muster (Reaktionsordnungen, Zeitgesetze), nach denen eine Reaktion verlaufen kann.Die Halbwertszeit hängt also von der Anfangskonzentration ab – das kann man leicht verstehen.2 Salze, Löslichkeit 4. Chemische Reaktion Dauer: 04:28 Reaktionsgleichung Dauer: 05:10 Reaktionsgleichungen Übungen Dauer: 04:47 Stöchiometrie Dauer: 04:30 Prinzip vom kleinsten Zwang Dauer: 04:46 Chemie im Labor. Die Iodatlösung wird von Hydrogensulfit zum Iodid reduziert: IO 3-+ 3 HSO 3- → I + 3 HSO 4 – (langsam) Iodid und Iodat reagieren in saurer Lösung unter Bildung von elementarem Iod, welches mit Stärke eine blaue Einlagerungsverbindung bildet: I-+ IO 3 + 6 H+ → 3 I 2 + 3 .Die Reaktionsmolekularität kann nicht so einfach experimentell ermittelt werden wie die Reaktionsordnung.Grundbegriffe der Reaktionstechnik: Reaktion, Reaktionsgeschwindigkeit, Reaktionsordnung und Reaktor. Februar 2022 by Aditi Roy. die eigentliche Reaktionskinetik: Physikalische Chemie: Reaktions kinetik mit der Stoßtheorie bzw.Kinetik chemischer Reaktionen Für die Voraussage, ob eine chemische Reaktion tatsächlich wie ge . Eine graphische Darstellung der Stabilitätsbereiche der Phasen in Abhängigkeit von den Zustandsvariablen wie Druck, Temperatur, chemischer Zusammensetzung und . Der Reaktionsmechanismus beschreibt den detaillierten Verlauf einer chemischen Reaktion in allen Teilschritten.)
Molekularität & Reaktionsordnung: Überblick
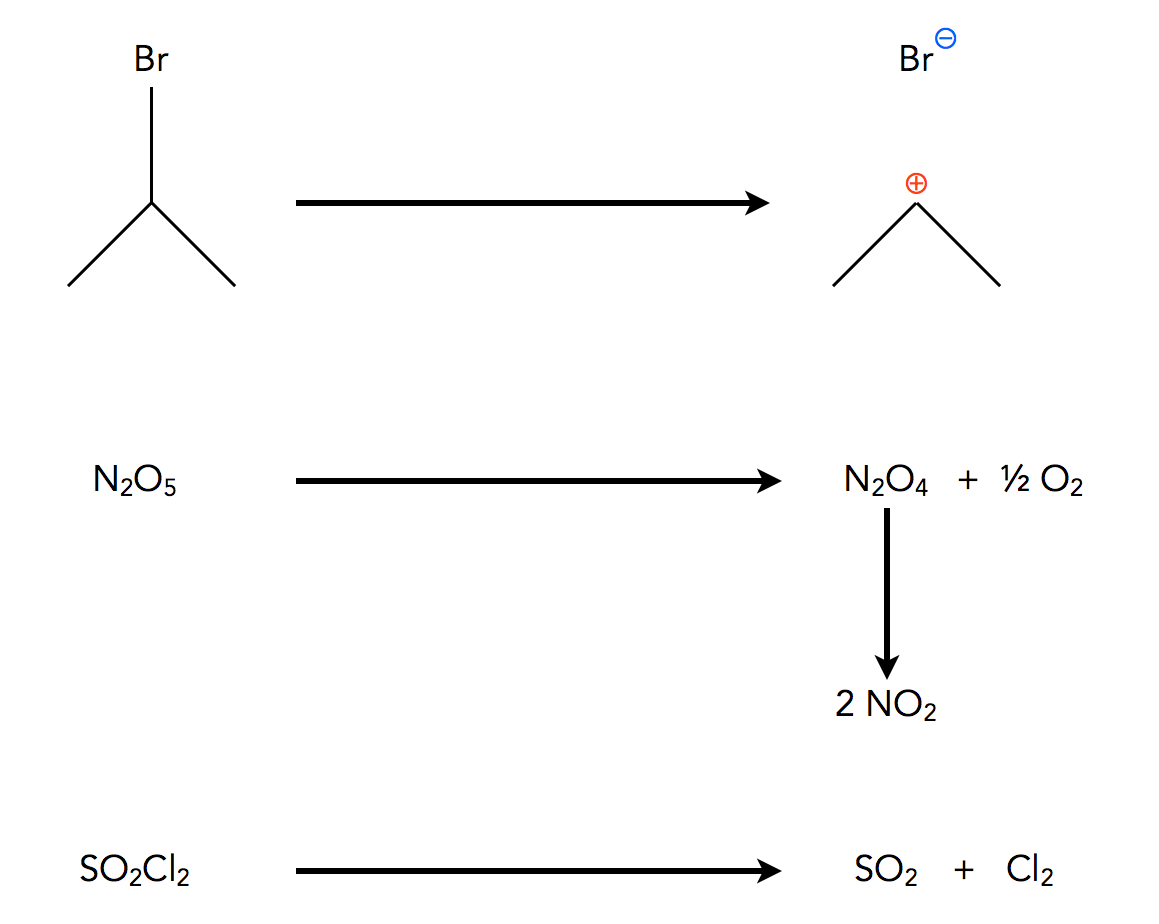
In dieser Playlist lernst du die Grundlagen chemischer Reaktionen kennen.Ein Vergleich dieser Graphen zeigt: Zu Beginn nimmt die Reaktionsgeschwindigkeit bei allen Reaktionsordnungen annähernd linear ab. Reakti o nsordnung, beschreibt die Kinetik einer chemischen Reaktion ( Reaktionskinetik ), die nach dem Einfluß der Reaktionsteilnehmer auf die Reaktionsgeschwindigkeit unterschieden wird. Wir können diese natürlich mit 2 multiplizieren und die Konstante k 2 ‚ = 2 · k 2 einführen, um die DGL zu erhalten, die in den meisten Lehrbüchern behandelt wird: . Arbeitsblätter.11 Beispiel Reaktion erster Ordnung: Detaillierte Erläuterungen.Ordnung € − d[A] dt =k 2 [A] 1 [B] 1 Zeitgesetz für Reaktion 2.Die Reaktionsordnung erlaubt die Einordnung in einen mathematischen Formalismus, d. Für den Fall des Distickstoffpentoxids, 2N 2 O 5 → 4NO 2 + O 2, wurde die folgende Gesetzmäßigkeit im Experiment beobachtet: − d [N 2 O 5] / dt = k 1 [N 2 O 5] Reaktionsordnung ab. Diese Wertepaare und die Ausgangskonzentration kann man in das umgeformte Zeitgesetz der entsprechenden Reaktionsordnung einsetzen und graphisch auftragen (Arrhenius .Kinetik (Chemie) Die Kinetik ist ein Teilbereich der physikalischen Chemie.6 Nichtmetallverbindungen 4. Die Lösung der DGL erfolgt nach dem selben .Chemische Reaktionen als Stoffumwandlung. Wenn wir diese Gleichung etwas umformen und zu endlichen Änderungen übergehen (d → Δ), Δ [A] / [A] = k 1 Δt, dann erkennen wir, dass die . Eine Umwandlung von Elementen in Verbindungen und umgekehrt erkennt man daran, dass sich die chemischen und physikalischen . Ist a = 1, handelt es sich um eine Reaktion erster Ordnung. BY-NC-SA Wichtiger Hinweis zu diesem Artikel 22. Die Reaktionsgeschwindigkeit ist eine Größe der chemischen Kinetik.

eine Reaktion 3. − d[A] / dt = k 2 ‚ [A] 2. Man unterscheidet zwischen 0. Alle Arbeitsblätter zum Thema Arbeitsblätter zum Thema.
Mechanismus chemischer Reaktionen in Chemie
Die meisten Reaktionen, gerade in der organischen Chemie .Die Kinetik ist ein Teilbereich der physikalischen Chemie.Reaktionsordnungen. Zwischen der Form der stöchiometrischen Gleichung der Reaktion und der . (00:14) Chemische Stoffe können miteinander reagieren und in andere Verbindungen umgeformt werden.
- Cheque En Français : Les chèques en Suisse
- Charles De Gaulle Parents | Charles de Gaulle : généalogie par pjame
- China Und Asiatische Entwicklung
- Chatverlauf Von Line Importieren
- Checkliste Für Backup Tests _ IDCL-P
- Chicken Nuggets Aufwärmen Im Airfryer
- China Mobile Aktienfinder _ Dividende von China Construction Bank H im April 2024
- Charlotte Boehringer Benedikt Toth
- Chemie Programm – SYNTHIA™ Retrosynthesis Software
- Chelsea Stadium Tour And Museum
- Chartered Accountants History _ History
- Chicago Events This Weekend _ Chicago, IL All All Events This Weekend
- Chinesische Buffet In Der Nähe