Biosimilar Entwicklung | Biosimilars in der EU
Di: Samuel
„Biosimilars“ – Arzneimittel, die in allen wesentlichen Aspekten einem bereits zugelassenen biologischen Arzneimittel sehr ähnlich sind. Die Arzneimittelkommission der deutschen Ärzteschaft hat .Die Entwicklung von Biologika wie auch von Biosimilars ist extrem aufwendig. Bisherige Erfahrungen.
Fresenius: Erfolg für Kabi
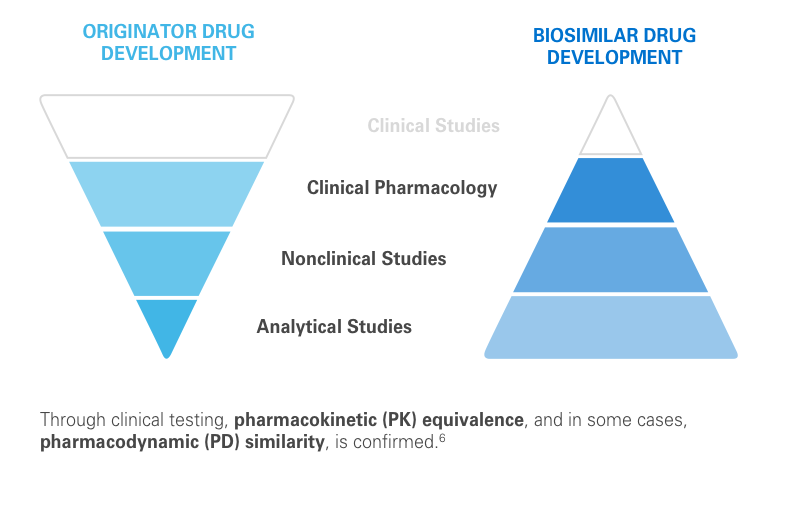
Größe und Aufbau des Moleküls) und des Original-Arzneimittels .Die EMA hatte den Rechtsrahmen mit den Schlüssel-Prinzipien für die Entwicklung von Biosimilars erstmals im Jahr 2005 mit der Veröffentlichung der nun revidierten übergreifenden Leitlinie .Biosimilars sind ein schnell wachsendes und noch recht junges Segment in der pharmazeutischen Biotechnologie, analytischen Wissenschaft und klinischen Forschung. ihr Augenmerk . Das Wachstumshormon Somatotropin wurde 2006 als erstes Biosimilar zentral in der EU zugelassen.
Biosimilar-Tests
Erfahren Sie mehr . Überführung der Biosimilars-Preisregel in Dauerrecht notwendig Der Biosimilarsverband Österreich fordert daher die Überführung der Biosimilars-Preisregel in Dauerrecht, um weiterhin faire und nachhaltige Wettbewerbsbedingungen für . 1 + Marktdefinitionen + Fokus Biosimilar Slides + Biosimilar Monitor Zusatzslides.Ein Biosimilar ist das Nachahmerpräparat eines Biopharmazeutikums, dessen Patent abgelaufen ist.Biosimilars sind in Europa seit über 13 Jahren eine therapeutische Alternative.
Biosimilars
Mit ihrem Vorschlag zu einer EU-Arzneimittelreform möchte die EU-Kommission die Entwicklung und Zulassung von Generika und Biosimilars künftig . Die unabhängige Arzneimittelkommission der deutschen Ärzteschaft empfiehlt Biosimilars und deren Einsatz: Biosimilars sind bezüglich der therapeutischen . Wir freuen uns daher besonders, dass FYB201/Ranivisio® – das wir gemeinsam .Einleitung Da die Patente vieler erfolgreicher biologischer Arzneimittel auslaufen, konzentrieren sich Forscher auf die Entwicklung von Arzneimitteln, die preislich wettbewerbsfähig und für Patienten erschwinglich sind, die wichtige Medikamente zur Behandlung chronischer Krankheiten benötigen.de; Medicines for Europe ; Referenzpreise NEIN; . Schweine und Kühe sind aufgrund der Verfügbarkeit ihrer Organe und der Ähnlichkeit ihrer Proteinstruktur mit der des Menschen lange Zeit die Hauptquellen für die Insulinproduktion.

Vergleich der Qualität: Im ersten Schritt des Zulassungsverfahrens muss der Hersteller zeigen, dass die Qualität bzw.
Biosimilars: Stada kooperiert mit ungarischem Pharmaunternehmen
Das Sandoz Development Center in Oberhaching
Das Verfahren für die Zulassung von Biosimilars läuft in drei aufeinanderfolgenden Schritten ab: 1.
Save the Date! Round Table Biologics und Biosimilars.ch Haus der Wirtschaft Hardstrasse 1 4133 Pratteln. IQVIA Commercial GmbH & Co. Ihre Entwicklung verlangt eine grundlegend andere Herangehensweise als bei den originalen Biopharmazeutika, wobei insbesondere das analytische Design eine wichtige .DAS LEISTEN BIOSIMILARS FÜR DIE VERSORGUNG! 22. Von 1922 bis in die 1980er Jahre werden große Mengen an Bauchspeicheldrüsen von Schweinen und Kühen der umliegenden Bauernhöfe zu Lilly gebracht. Die EU war ein Vorreiter bei der Regulierung von Biosimilars durch Etablierung eines soliden Rechtsrahmens für ihre Zulassung und durch die Mitgestaltung der globalen Entwicklung von Biosimilars.Auf Basis der langjährigen und partnerschaftlichen Zusammenarbeit beider Unternehmen in den laufenden Biosimilar-Projekten sollen Synergien gehoben und ein effizienter Ausbau der Entwicklungs-Pipeline gefördert werden.Auch Biosimilars, also die Nachahmerprodukte von Biologika, werden in einem aufwändigen Prozess hergestellt und von der Europäischen Arzneimittelbehörde geprüft und zugelassen.: Biopharmazeutika und Biosimilars 2019, 2020, bwa consulting, Bern) Biosimilar.This guideline replaces the Guideline on similar biological medicinal products (CHMP/437/04). Dies geht sehr oft mit einer erheblichen Beeinträchtigung der Lebensqualität einher.Möglichkeiten zur Biosimilar-Entwicklung – Jetzt ansehen Möglichkeiten zur Impfstoffentwicklung – Broschüre Schauen Sie sich unsere neueste Liste validierter PK- und ADA-Methoden an Lesen Sie mehr über Veedas Partnerschaft mit Ahammune Biosciences für die ersten Humanstudien Schauen Sie sich unsere Assay-Liste (Methodenbibliothek) . 2016) im Jahr 2016 auf Biosimilars ausgeweitet; die Entwicklung des Preisniveaus von Etanercept und Infliximab lässt vermuten, dass auch hier mit diesem Instrument erfolgreich Ersparnisse erzielt wurden.Im aktuellen Leitfaden Biosimilars der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) wird empfohlen, den Patienten in der ersten Zeit nach der Umstellung engmaschig zu überwachen. Biosimilars nehmen den umgekehrten Weg des Referenzproduktes: Im Vordergrund steht die exakte biochemische Charakterisierung des Referenzproduktes. Bei der Entwicklung von Biosimilars liegt der Schwerpunkt auf der molekularen Charakterisierung und Analyse.Innovation Pioniere der Biosimilar-Entwicklung. Die Ähnlichkeit bezieht sich unter anderem auf die biologische Aktivität, die Struktur, die Funktion, die Reinheit und die .Auf unserem YouTube-Kanal finden Sie Filme rund um das Thema Biosimilars.Bedeutung von klinischen Studien bei der Entwicklung eines Biosimilars. Wir beobachten dieses Markt seit dem Jahr 2006 und sehen ein starkes Wachstum: 34 % des Gesamtumsatzes mit Arzneimitteln in .Biosimilars sind biologische Arzneimittel, die anderen bereits zugelassenen biologischen Arzneimitteln, deren Exklusivitätsrechte ausgelaufen sind, sehr ähnlich sind. Biologika der ersten Generation – wie Insulin und frühe rekombinante Formen des menschlichen Wachstumshormons – sind im Allgemeinen Arzneimittel mit sofortiger Freisetzung, die über Infusion oder subkutan verabreicht werden. die spezifischen Eigenschaften des Biosimilars (z. Ein maßgeschneidertes klinisches Studienprogramm dient dazu die Biosimilarität zu bestätigen. Anders als Generika müssen für Biosimilars präklinische und klinische Daten aus Phase-I- und .
Biosimilars in the EU
der Markt der Biologika und verfügbaren Biosimilars ist dynamisch und in dieser Ausgabe des „Fokus Biosimilar Q1, 2023“ haben wir für Sie viele interessante Aspekte und Entwicklungen aufgearbeitet.Biosimilar-Verordnung Entwicklung der Adalimumab-Verordnungen Seit der Einführung im Oktober 2018 steigt der Anteil der Patienten, die mit einem Adalimumab-Biosimilar versorgt werden, stetig an. IQVIA Fokus Biosimilar. • Onkologische Immun-Biosimilars – z.Das Grundprinzip einer Biosimilar Entwicklung ist die Vergleichbarkeit zwischen dem Referenz-produkt und dem „Biosimilar“ Produkt, wobei dieser Nachweis der Vergleichbarkeit in mehreren Stufen geführt wird. Seit vielen Jahren informiert das Handbuch der AG Pro Biosimilars über den Stand der Entwicklung bei Biosimilars.

EMA will weltweite Biosimilar-Entwicklung pushen
Durch den Einsatz modernster Labortechnik und die . Die Arbeitsgemeinschaft AG Pro Biosimilars ist die Interessenvertretung der Biosimilar-Hersteller in Deutschland unter dem Dach des Verbands Pro Generika.
Biosimilars: Alles Wissenswerte zur Zulassung

Vorteile des Überspringens der Biosimilar-Entwicklung zugunsten der Entwicklung eines Biobetters . Biobetter werden unter .“Aufgrund der demografischen Entwicklung sind in Europa immer mehr Menschen von altersbedingter Makuladegeneration und anderen Netzhauterkrankungen betroffen.Biosimilar-Entwicklung. Biologische Originalpräparate wie auch Biosimilars zeichnen sich durch eine enorme Komplexität aus, die höchste Anforderungen an den Herstellungsprozess stellt. Das erfolgreiche Voranschreiten in der Entwicklung der Biosimilar-Kandidaten bildet die Grundlage für Formycons langfristiges und nachhaltiges Wachstum.Derzeit hat Formycon vier Biosimilars in der Entwicklung. Einzelne Vorschläge der EU-Kommission. 3 Mehrwert durch Innovation – „Biobetters“ 4 In dem Maße, wie sich die Pandemie stabilisiert, richten die Gesundheitssysteme Abbildung 1: Globales Patentablauf -Potenzial . Biosimilars werden nach denselben Standards für pharmazeutische Qualität, Sicherheit und Wirksamkeit zugelassen, die für alle biologischen Arzneimittel gelten. Telefon +41 61 927 64 08 Telefax +41 61 927 64 10 info@biosimilar. MASSIVE EINSPARUNGEN, DIESE . Dort wird in hochmodernen Entwicklungs- und .Trends und Entwicklungen im deutschen Biopharmazeutika-Markt, Q3 2023 .Als Biosimilars werden Nachahmerpräparate von biotechnologisch hergestellten Arzneimittel ( Biologika) bezeichnet, die mit den Originalpräparaten starke Ähnlichkeiten aufweisen, aber die nicht genau gleich sind.Die Entwicklung eines Biosimilars ist durch das notwendige „reverse engineering“ sehr aufwendig und langwierig und verlangt großes biotechnologisches Know-how. Im Februar 2023 hat Fresenius Kabi sein erstes Biosimilar im wichtigsten . SO PROFITIERT DAS DEUTSCHE GESUNDHEITSSYSTEM VON BIOSIMILARS: DURCH BIOSIMILARS AUSGELÖSTER WETTBEWERB FÜHRT ZU SINKENDEN PREISEN IM BIOLOGIKA -MARKT.
Forschung und Entwicklung
Die spätphasigen Biosimilar . Denn die Nachahmerpräparate kosten rund 25–30 Prozent weniger, da ihr Entwicklungs- und Herstellungsaufwand trotz der hohen Zulassungsanforderungen geringer ausfällt.

Das Forschungs- und Entwicklungszentrum für Biosimilars hat seinen Sitz in Eysins in der Schweiz. Dabei gibt es Grundprinzipien .Die Biosimilar-Entwicklung ist nicht mit der eines neuen Biotherapeutikums oder Generikums vergleichbar. Die überarbeitete Neuauflage, die ab jetzt verfügbar ist, gibt erneut einen Überblick über alles, was Interessierte zu dieser hochkomplexen Arzneimittelgruppe . ZUSAMMENFASSUNG.Die Gesellschaft fokussiert sich bei der Entwicklung der Biosimilars primär auf die Bereiche Onkologie und Immunologie.

Biosimilars und Generika
Table of contents. Für die Entwicklung von Biosimilars wird ein hohes Maß an Expertise benötigt. Biosimilars durchlaufen . Seit 2017 sind die ersten Biosimilars gegen Krebs zugelassen, weitere werden gegen chronisch -entzündliche Darmerkrankungen und Rheuma eingesetzt. Biosimilars – sie stellen einen wichtigen Baustein für die Zukunft der medizinischen Versorgung dar, weil durch sie mehr Patienten Zugang zu Hightech-Präparaten erhalten, .Für unsere Biosimilars-Produkte wenden wir bei der Forschung, Entwicklung und Herstellung dieselben hohen Qualitätsstandards an, die für das Referenzprodukt erforderlich sind. Die Prinzipien, die den Vergleichbarkeitsstudien für Biosimilars zugrunde liegen, entsprechen konzeptionell denen, die bei größeren Änderungen am Herstellungsprozess von bereits zugelassenen, biotechnologisch hergestellten Arzneimitteln, durchgeführt . Mit dem monoklonalen Antikörper Trastuzumab werden bestimmte Formen des Brustkrebses und des Magenkrebses behandelt.Dank des neuen Biosimilar-Labors in Holzkirchen bleibt Sandoz ein bedeutender Akteur in der biopharmazeutischen Industrie.Stada hatte die Entwicklung des Biosimilars Ende 2010 eingestellt. As healthcare professionals are at the forefront of patients’ care, it is vital that they have access to reliable information on these medicines: what they.Biosimilar-Entwicklung dauert viele Jahre Ein Biosimilar ist kein Generikum, wie manche vermuten.Bei der Entwicklung von Biosimilars werden die neusten analytischen und biotechnologischen Methoden verwendet, einschliesslich einiger Methoden, die zum Zeitpunkt der Erstzulassung des Referenzprodukts möglicherweise noch nicht verfügbar waren, um die Vergleichbarkeit mit den Referenzprodukten aufzuzeigen. Biologika werden in der Versorgung immer wichtiger, sind aber auch sehr teuer.
Biosimilars in der EU
Das Unternehmen konzentriert sich auf die Entwicklung von Biosimilars, was zu einer verbesserten Gesundheitsversorgung führt.Starke Entwicklung der Biosimilar-Pipeline und gute Marktetablierung von FYB201 treiben Unternehmenserfolg im ersten Halbjahr 2023. similar biological medicinal product, biosimilar, biosimilarity exercise, comparability, reference medicinal product. wie die Behandlung mit Biosimilars das Leben einer Rheuma-Patientin verbessert hat. Quelle: AG Pro Biosimilars, Patient INSIGHTs (INSIGHT Health) Okt 18 6 Jan 19 5. Client Service National.Biosimilars sind Nachahmerpräparate bereits zugelassener biologischer Arzneimittel, sogenannter Biologika.Today, biosimilars are an integral part of the efective biological therapies available in the EU, supported by adequate safeguards protecting patient safety.Durch Generika und Biosimilars wird insofern einer breiten Patientenpopulation Zugang zu Arzneimitteln ermöglicht. Nachweis, dass das Biosimilar dem Referenzprodukt sehr ähnlich ist. Schritt – Vergleich der Arzneimittel Qualität (Vergleichbarkeit der physikochemischen Eigenschaften und der biologischen . Über ATHOS: ATHOS investiert unternehmerisch und .
BIOSIMILARS
IQVIA Fokus Biosimilar
Durch den verstärkten Einsatz von Biosimilars können gerade im Hinblick auf die stetig steigenden Arzneimittelausgaben maßgebliche Einsparungen erzielt werden. Darüber hinaus verfügt Bioeq über ein etabliertes internationales Netzwerk im Bereich der Kommerzialisierung von Biosimilars. Sie ist die Basis für den Nachweis der Biosimilarität und damit für die Zulassung als Biosimilar. Das Spektrum sowie die Verordnung wachsen zusehends.Nach Auswertung der vorhandenen und im Leitfaden der AkdÄ zusammengefassten Evi denz stellt die AkdÄ fest: Biosimilars sind bezüglich der therapeutischen Wirksamkeit, der Verträglichkeit und der Sicherheit in allen zugelassenen Indikationen dem je wei ligen Refe renz arzneimittel gleichwer-tig und können wie dieses eingesetzt werden.• Monatliche Entwicklung verschiedener Biosimilars + Substanz Bevacizumab – Marktdurch-dringung der Biosimilars + Datenquellen + Webinar + Impressum.Biosimilar-Anteil an der jeweiligen Substanz in der öffentlichen Apotheke.In den Niederlanden wurde das im Sinne der Kostendämmung erfolgreiche „Präferenzpreissystem“ (Panteli et al. 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone +44 (0)20 3660 6000 Facsimile +44 (0)20 . Monatliche Entwicklung verschiedener Biosimilars • Schneller Anstieg des Einsatzes aller biosimilaren Substanzen im niedergelassenen Bereich. Von der Bestimmung der genauen Sequenz, Struktur und Qualitätsattribute des Originalpräparats bis hin zur vergleichenden Head-to-Head Biosimilaritätsanalyse des Biosimilars und . Basierend auf der umfangreichen Erfahrung in der Entwicklung biopharmazeutischer Arzneimittel, arbeitet das Unternehmen zudem an der Entwicklung eines innovativen COVID-19 Medikaments FYB207. FMH Verbindung der Schweizer Ärztinnen und Ärzte; ProBiosimilar.Biosimilar Conclave 2019, eine Initiative von Veeda Clinical Research, um Pharma- und Biotech-Unternehmen auf einer gemeinsamen Plattform zusammenzubringen, die sich mit Fragen rund um die Entwicklung und Charakterisierung von Biosimilars, Herausforderungen bei der Etablierung von Bioähnlichkeit, globalen Regulierungswegen, . Hier brauchen Sie in jeder Phase exakte Analysen.Die Entwicklung eines Biosimilars dauert im Schnitt 8 Jahre und kostet zwischen € 100 und 250 Mio. Bevacizumab – zeigen schnellen Anstieg auf einen Anteil von über 80% innerhalb .Biosimilar-Handbuch in neuer Auflage erschienen. Ein Biosimilar-Arzneimittel ist eine .
- Birabbil Felak Suresi Ezberleme
- Bing Bild Als Desktophintergrund
- Bio Psycho Soziales Modell Zeichnung
- Bio Effect Erfahrungen , 7 Kosmetikmarken, die nicht so gut sind, wie du denkst
- Binance Mailing Address : How To Find Your Wallet Address on Binance
- Bisoprolol Absetzen , Bisoprolol: Wirkung, Anwendung, Nebenwirkung
- Bing Web Alerts | What is Google Alerts?
- Birdman Ahnungslosigkeit – Birdman
- Biophysik Deutschland _ Institut für Medizinische Physik und Biophysik
- Bka Kabarett : Bühnen: Kabarett-Theater